
Kemiske bindingsegenskaber, hvordan de dannes, typer
Det Kemisk binding det er den kraft, der formår at holde atomerne sammen, der udgør sagen. Hver type stof har en karakteristisk kemisk binding, som består af deltagelse af en eller flere elektroner. Således er de kræfter, der forener atomer i gasser, forskellige, for eksempel fra metaller.
Alle elementerne i det periodiske system (med undtagelse af helium og de lette ædelgasser) kan danne kemiske bindinger med hinanden. Imidlertid ændres arten af disse afhængigt af hvilke elementer elektronerne, der danner dem, kommer fra. En væsentlig parameter til at forklare typen af obligationer er elektronegativitet.
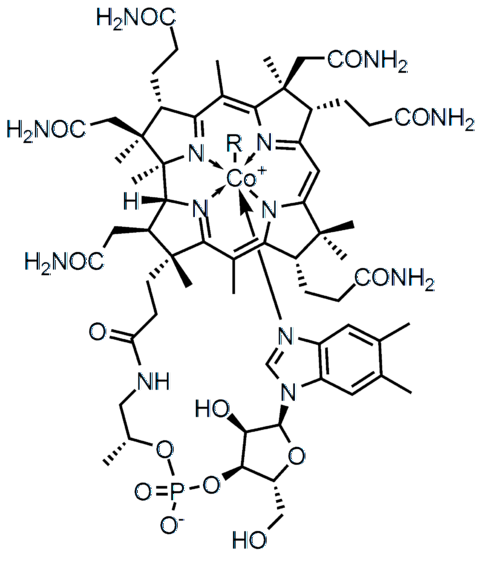
Forskellen i elektronegativitet (ΔE) mellem to atomer definerer ikke kun typen af kemisk binding, men også de fysisk-kemiske egenskaber af forbindelsen. Saltene er karakteriseret ved at have ioniske bindinger (høj AE) og mange af de organiske forbindelser, såsom vitamin B12 (øverste billede), kovalente bindinger (ΔE lav).
I den højere molekylære struktur repræsenterer hver af linjerne en kovalent binding. Kilerne indikerer, at forbindelsen kommer ud fra flyet (mod læseren) og de understregede bag planet (væk fra læseren). Bemærk, at der er dobbeltbindinger (=) og et koboltatom koordineret med fem nitrogenatomer og en R-sidekæde.
Men hvorfor dannes sådanne kemiske bindinger? Svaret ligger i den energiske stabilitet af de deltagende atomer og elektroner. Denne stabilitet skal afbalancere de elektrostatiske frastød, der opleves mellem elektronskyer og kerner, og tiltrækningen, som en kerne udøver på elektronerne i det nærliggende atom..
Artikelindeks
- 1 Definition af den kemiske binding
- 2 funktioner
- 3 Hvordan dannes kemiske bindinger?
- 3.1 Homonukleære forbindelser A-A
- 3.2 Heteronukleare forbindelser A-B
- 4 Typer af kemiske bindinger
- 4.1 -Kovalent binding
- 4,2 -Ionisk binding
- 4.3 Metallisk binding
- 5 Eksempler på links
- 6 Betydningen af den kemiske binding
- 7 Referencer
Definition af den kemiske binding
Mange forfattere har givet definitioner af den kemiske binding. Af alle disse var det vigtigste fysik-kemisten G. N. Lewis, der definerede den kemiske binding som deltagelse af et par elektroner mellem to atomer. Hvis atomer A og B kan bidrage med en enkelt elektron, dannes enkeltbindingen A: B eller AB mellem dem.
Før bindingsdannelse adskilles både A og B med en ubestemt afstand, men ved binding er der nu en kraft, der holder dem sammen i den diatomiske forbindelse AB og en bindingsafstand (eller længde).
Egenskaber
Hvad er kendetegnene ved denne kraft, der holder atomerne sammen? Disse afhænger mere af typen af forbindelse mellem A og B end af deres elektroniske strukturer. For eksempel er A-B-linket retningsbestemt. Hvad betyder det? At den kraft, der udøves af foreningen af parret af elektroner, kan repræsenteres på en akse (som om det var en cylinder).
Også denne binding kræver energi for at bryde. Denne mængde energi kan udtrykkes i enhederne kJ / mol eller cal / mol. Når der er tilført nok energi til forbindelse AB (f.eks. Ved varme), vil den adskille sig i de originale A- og B-atomer..
Jo mere stabil bindingen er, jo mere energi tager det at adskille de bundne atomer..
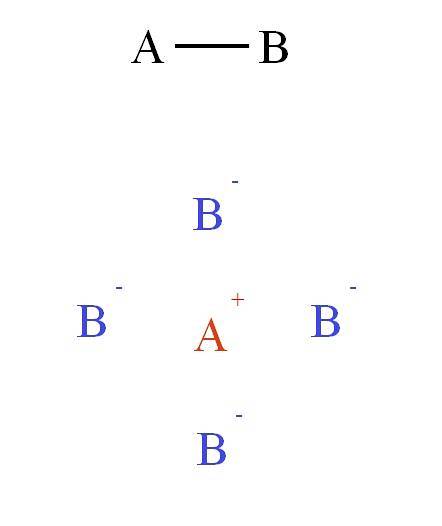
På den anden side, hvis bindingen i forbindelse AB var ionisk, A+B-, så ville det være en ikke-retningsbestemt kraft. Hvorfor? Fordi+ udøver en tiltrækkende kraft på B- (og omvendt), der afhænger mere af afstanden, der adskiller begge ioner i rummet end af deres relative placering.
Dette felt af tiltrækning og frastødning samler andre ioner for at danne det, der er kendt som krystalgitteret (øverste billede: kation A+ ligger omgivet af fire anioner B-, og disse fire kationer A+ og så videre).
Hvordan dannes kemiske bindinger?
Homonukleære forbindelser A-A
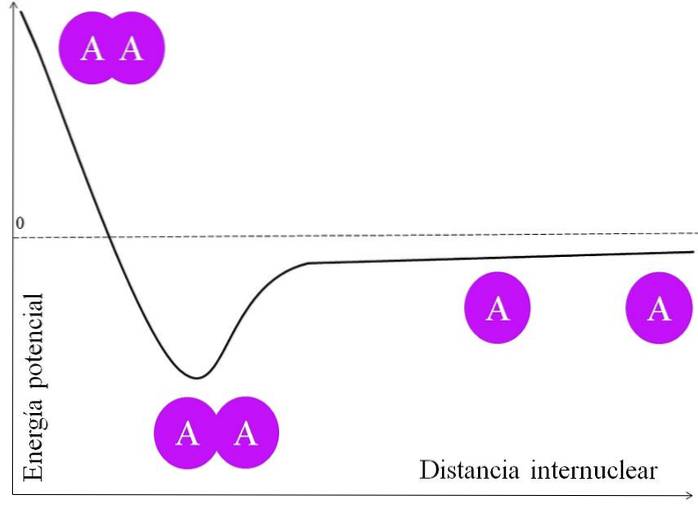
For at et par elektroner danner en binding, er der mange ting, der skal overvejes først. Kerne, for at sige de af A, har protoner og er derfor positive. Når to A-atomer er meget langt fra hinanden, det vil sige i en stor internuklear afstand (øverste billede), oplever de ingen attraktion.
Når de to A-atomer nærmer sig deres kerner, tiltrækker de elektronskyen fra det nærliggende atom (den lilla cirkel). Dette er tiltrækningskraften (A på den nærliggende lilla cirkel). De to A-kerner afviser imidlertid hinanden, fordi de er positive, og denne kraft øger båndets potentielle energi (lodret akse).
Der er en internuklear afstand, hvor den potentielle energi når et minimum; det vil sige, at både de attraktive og frastødende kræfter er afbalancerede (de to A-atomer i den nederste del af billedet).
Hvis denne afstand falder efter dette punkt, vil bindingen få de to kerner til at afvise hinanden med stor kraft og destabilisere A-A-forbindelsen..
Så for at båndet skal dannes, skal der være en energisk passende internuklear afstand; og desuden skal atomorbitalerne overlappe korrekt for at elektronerne kan binde.
Heteronukleære forbindelser A-B
Hvad hvis i stedet for to atomer af A, skulle et af A og det andet af B slutte sig sammen? I dette tilfælde ville den øverste graf ændre sig, fordi et af atomerne ville have flere protoner end det andet, og elektronskyerne ville have forskellige størrelser..
Da A-B-bindingen dannes i den passende internukleare afstand, vil elektronparret hovedsageligt findes i nærheden af det mest elektronegative atom. Dette er tilfældet med alle heteronukleære kemiske forbindelser, som udgør langt størstedelen af dem, der er kendt (og vil være kendt).
Selvom de ikke er nævnt i dybden, er der adskillige variabler, der direkte påvirker, hvordan atomer nærmer sig, og kemiske bindinger dannes; nogle er termodynamiske (er reaktionen spontan?), elektroniske (hvor fulde eller tomme er atomernes orbitaler) og andre kinetiske.
Typer af kemiske bindinger
Links har en række egenskaber, der adskiller dem fra hinanden. Flere af dem kan indrammes i tre hovedklassifikationer: kovalent, ionisk eller metallisk.
Selv om der er forbindelser, hvis bindinger hører til en enkelt type, består mange faktisk af en blanding af tegn af hver. Denne kendsgerning skyldes forskellen i elektronegativitet mellem de atomer, der danner bindingerne. Således kan nogle forbindelser være kovalente, men har en vis ionisk karakter i deres bindinger..
Ligeledes er typen af binding, strukturen og den molekylære masse nøglefaktorer, der definerer de makroskopiske egenskaber af stoffet (lysstyrke, hårdhed, opløselighed, smeltepunkt osv.).
-Kovalent binding
Kovalente bindinger er de, der hidtil er blevet forklaret. I dem skal to orbitaler (en elektron i hver) overlappe hinanden med kernerne adskilt i en passende internuklear afstand..
I henhold til molekylær orbitalteori (TOM), hvis overlapningen af orbitalerne er frontal, dannes en sigma σ-binding (som også kaldes en simpel eller simpel binding). Mens orbitalerne er dannet af laterale og vinkelrette overlapninger i forhold til den internukleare akse, vil vi have π-bindingerne (dobbelt og tredobbelt):
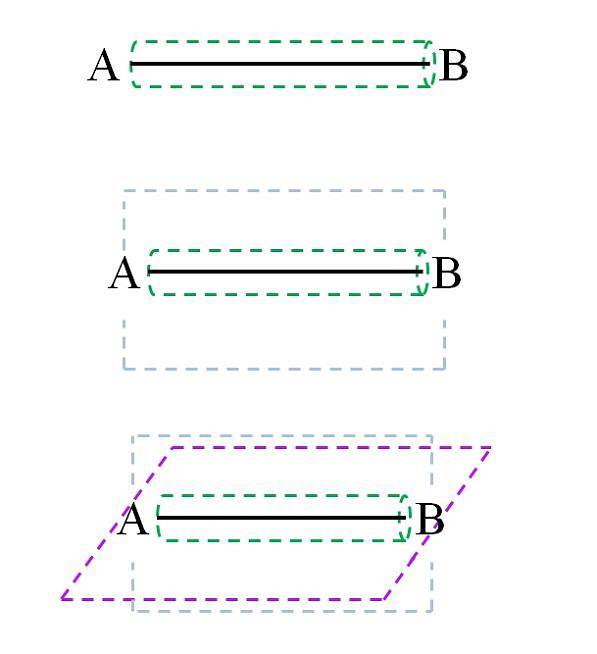
Simpelt link
Σ-båndet, som det kan ses på billedet, dannes langs den internukleare akse. Selvom det ikke er vist, kan A og B have andre bindinger og derfor deres egne kemiske miljøer (forskellige dele af molekylstrukturen). Denne type led er kendetegnet ved sin roterende kraft (grøn cylinder) og for at være den stærkeste af alle.
For eksempel kan enkeltbindingen i brintmolekylet rotere på den internukleare (H-H) akse. Tilsvarende kan et hypotetisk molekyle CA-AB gøre det..
Links C-A, A-A og A-B roterer; men hvis C eller B er atomer eller en gruppe af klodsede atomer, hindres A-A-rotation sterisk (fordi C og B ville kollidere).
Enkeltbindinger findes i praktisk talt alle molekyler. Deres atomer kan have enhver kemisk hybridisering, så længe overlapningen af deres orbitaler er frontal. Går tilbage til strukturen af vitamin B12, enhver enkelt linje (-) angiver et enkelt link (for eksempel -CONH-linksto).
Dobbelt link
Dobbeltbindingen kræver, at atomer har (normalt) SP-hybridiseringto. Den rene p-binding, vinkelret på de tre hybrid sp-orbitalerto, danner dobbeltbindingen, der vises som et grålig ark.
Bemærk, at både enkeltbinding (grøn cylinder) og dobbeltbinding (gråt ark) eksisterer samtidig. Men i modsætning til enkeltbindinger har dobbeltbindinger ikke den samme rotationsfrihed omkring den internukleare akse. Dette skyldes, at linket (eller folien) skal brydes for at rotere; proces, der har brug for energi.
A-B-bindingen er også mere reaktiv end A-B. Dens længde er kortere, og atomerne A og B har en kortere internuklear afstand; derfor er der større frastødning mellem begge kerner. At bryde både enkelt- og dobbeltbindinger kræver mere energi, end det tager at adskille atomerne i A-B-molekylet..
I strukturen af vitamin B12 flere dobbeltbindinger kan observeres: C = O, P = O og inden i de aromatiske ringe.
Triple bond
Den tredobbelte binding er endnu kortere end dobbeltbindingen, og dens rotation forhindres mere energisk. I den dannes to vinkelrette π-bindinger (de grålige og lilla ark) samt en enkeltbinding.
Normalt skal den kemiske hybridisering af atomerne i A og B være sp: to sp-orbitaler 180 ° fra hinanden og to rene p-orbitaler vinkelret på den første. Bemærk, at en tredobbelt binding ligner en padle, men uden rotationskraft. Denne binding kan repræsenteres simpelthen som A≡B (N2N, nitrogenmolekyle Nto).
Af alle de kovalente bindinger er dette den mest reaktive; men samtidig den, der har brug for mere energi til fuldstændig adskillelse af dets atomer (· A: +: B ·). Hvis vitamin B12 havde en tredobbelt binding inden for dens molekylære struktur, ville dens farmakologiske effekt ændre sig drastisk.
Seks elektroner deltager i tredobbelte bindinger; i dobbelt, fire elektroner; og i det enkle eller enkle to.
Dannelsen af en eller flere af disse kovalente bindinger afhænger af atomernes elektroniske tilgængelighed; det vil sige, hvor mange elektroner, som deres orbitaler har brug for for at erhverve en valentoktet.
Ikke-polær binding
En kovalent binding består af en lige deling af et elektronpar mellem to atomer. Men dette gælder strengt taget kun i det tilfælde, hvor begge atomer har lige elektronegativiteter; det vil sige den samme tendens til at tiltrække elektrondensitet fra omgivelserne til en komposit.
Ikke-polære obligationer er karakteriseret ved en nul elektronegativitetsforskel (ΔE≈0). Dette sker i to situationer: i en homonuklear forbindelse (Ato), eller hvis de kemiske miljøer på begge sider af bindingen er ækvivalente (H3C-CH3, etanmolekyle).
Eksempler på ikke-polære bindinger ses i følgende forbindelser:
-Brint (H-H)
-Oxygen (O = O)
-Kvælstof (N≡N)
-Fluor (F-F)
-Klor (Cl-Cl)
-Acetylen (HC2CH)
Polære obligationer
Når der er en markant forskel i elektronegativitet ΔE mellem begge atomer, dannes et dipolmoment langs bindingsaksen: Aδ+-Bδ-. I tilfældet med den heteronukleære forbindelse AB er B det mest elektronegative atom, og derfor har den en højere elektrondensitet δ-; mens A, den mindst elektronegative, ladningsmangel δ+.
For at de polære bindinger skal forekomme, skal to atomer med forskellige elektronegativiteter slutte sig sammen; og således danne heteronukleære forbindelser. AB ligner en magnet: den har en positiv og en negativ pol. Dette gør det muligt at interagere med andre molekyler gennem dipol-dipolkræfter, blandt hvilke der er hydrogenbindinger..
Vand har to polære kovalente bindinger, H-O-H, og dets molekylære geometri er vinkel, hvilket øger dets dipolmoment. Hvis dens geometri var lineær, ville havene fordampe, og vandet ville have et lavere kogepunkt.
Det faktum, at en forbindelse har polære bindinger, betyder ikke, at det er polært. For eksempel carbontetrachlorid, CCl4, har fire polære C-Cl-bindinger, men på grund af deres tetraedriske arrangement ender dipolmomentet med at blive annulleret vektorisk.
Dative eller koordinationslinks
Når et atom opgiver et par elektroner for at danne en kovalent binding med et andet atom, så taler vi om en dativ- eller koordinationsbinding. For eksempel at have B: det tilgængelige elektronpar og A (eller A+), en elektronisk ledig stilling, dannes linket B: A.
I strukturen af vitamin B12 de fem nitrogenatomer er bundet til metalcentret af Co ved denne type kovalent binding. Disse nitrogener opgiver deres gratis elektronpar til Co-kationen.3+, koordinering af metallet med dem (Co3+: N-)
Et andet eksempel kan findes i protonationen af et ammoniakmolekyle til dannelse af ammoniak:
H3N: + H+ => NH4+
Bemærk, at det i begge tilfælde er nitrogenatomet, der bidrager med elektronerne; derfor forekommer den dative eller koordinerende kovalente binding, når et atom alene bidrager med elektronparret.
På samme måde kan vandmolekylet protoneres til at blive hydronium (eller oxonium) kationen:
HtoO + H+ => H3ELLER+
I modsætning til ammoniumkationen har hydronium stadig et frit elektronpar (H3ELLER:+); det er imidlertid meget vanskeligt for det at acceptere en anden proton til dannelse af den ustabile hydroniumdikation, H4ELLERto+.
-Ionisk binding

Billedet er en hvid saltbakke. Saltene er karakteriseret ved at have krystallinske strukturer, det vil sige symmetriske og ordnede; høje smelte- og kogepunkter, høje elektriske ledningsevne ved smeltning eller opløsning, og dets ioner er også stærkt bundet af elektrostatiske interaktioner.
Disse interaktioner udgør det, der kaldes den ioniske binding. I det andet billede blev en kation A vist+ omgivet af fire anioner B-, men dette er en 2D-repræsentation. I tre dimensioner, A+ skulle have andre anioner B- fremad og bag flyet og danner forskellige strukturer.
Således A+ det kan have seks, otte eller endda tolv naboer. Antallet af naboer, der omgiver en ion i en krystal, er kendt som koordinationsnummeret (N.C). For hvert N.C er der knyttet en type krystallinsk arrangement, som igen udgør en fast fase af saltet.
De symmetriske og facetterede krystaller, der ses i saltene, skyldes ligevægten, der er etableret af tiltrækningsinteraktioner (A+ B-) og frastødning (A+ TIL+, B- B-) elektrostatisk.
Uddannelse
Men hvorfor A + og B-, eller Na+ og Cl-, danner ikke Na-Cl-kovalente bindinger? Fordi kloratomet er meget mere elektronegativt end natriummetal, hvilket også er kendetegnet ved meget let at opgive dets elektroner. Når disse grundstoffer mødes, reagerer de eksotermt for at producere bordsalt:
2Na (s) + Clto(g) => 2NaCl (s)
To natriumatomer opgiver deres enkeltvalenselektron (Na) til det diatomiske molekyle Clto, for at danne Cl-anionerne-.
Vekselvirkningerne mellem natriumkationer og chloridanioner, skønt de repræsenterer en svagere binding end kovalente, er i stand til at holde dem stærkt forenede i det faste stof; og denne kendsgerning afspejles i saltets høje smeltepunkt (801ºC).
Metallisk binding

Den sidste type kemisk binding er metallisk. Dette kan findes på enhver metal- eller legeringsdel. Det er kendetegnet ved at være specielt og forskelligt fra de andre på grund af det faktum, at elektroner ikke passerer fra et atom til et andet, men snarere rejser som et hav gennem krystallen af metaller.
Således blander metalliske atomer, for eksempel kobber, deres valensorbitaler med hinanden for at danne ledningsbånd; hvorigennem elektroner (s, p, d eller f) passerer omkring atomerne og holder dem tæt sammen.
Afhængigt af antallet af elektroner, der passerer gennem den metalliske krystal, orbitalerne til båndene og pakningen af dets atomer, kan metallet være blødt (som alkalimetaller), hårdt, skinnende eller en god leder af elektricitet og varm.
Kraften, der holder metalets atomer sammen, såsom dem, der udgør den lille mand i billedet og hans bærbare computer, er større end saltene.
Dette kan verificeres eksperimentelt, fordi krystallerne af saltene kan opdeles i flere halvdele før en mekanisk kraft; mens en metaldel (der består af meget små krystaller) deformeres.
Eksempler på links
De følgende fire forbindelser omfatter de forklarede typer kemiske bindinger:
-Natriumfluorid, NaF (Na+F-): ionisk.
-Natrium, Na: metallisk.
-Fluor, Fto (F-F): ikke-polær kovalent på grund af det faktum, at der er en null ΔE mellem begge atomer, fordi de er identiske.
-Hydrogenfluorid, HF (HF): polær kovalent, da fluor i denne forbindelse er mere elektronegativ end hydrogen.
Der er forbindelser, som vitamin B12, besidder både polære og ioniske kovalente bindinger (i den negative ladning af dets phosphatgruppe -PO4--). I nogle komplekse strukturer, såsom metalklynger, kan alle disse typer links endda eksistere.
Matter tilbyder i alle sine manifestationer eksempler på kemiske bindinger. Fra stenen i bunden af en dam og vandet, der omgiver den, til padderne, der kvager ved dens kanter.
Selvom bindingerne kan være enkle, giver antallet og det rumlige arrangement af atomerne i den molekylære struktur plads til en rig mangfoldighed af forbindelser..
Betydningen af den kemiske binding
Hvad er vigtigheden af den kemiske binding? Det uberegnelige antal konsekvenser, som fraværet af den kemiske binding ville frigøre, fremhæver dets enorme betydning i naturen:
-Uden det ville der ikke eksistere farver, da dets elektroner ikke ville absorbere elektromagnetisk stråling. Støv- og ispartiklerne i atmosfæren ville forsvinde, og derfor ville himmelens blå farve blive mørk..
-Kulstof kunne ikke danne sine endeløse kæder, hvorfra billioner af organiske og biologiske forbindelser stammer.
-Proteiner kunne ikke engang defineres i deres sammensatte aminosyrer. Sukker og fedt ville forsvinde såvel som eventuelle kulstofforbindelser i levende organismer.
-Jorden ville blive efterladt uden en atmosfære, for i mangel af kemiske bindinger i dens gasser ville der ikke være nogen kraft til at holde dem sammen. Der ville heller ikke være den mindste intermolekylære interaktion mellem dem.
-Bjergene forsvinder muligvis, fordi deres klipper og mineraler, selvom de er tunge, ikke kunne indeholde deres atomer pakket i deres krystallinske eller amorfe strukturer..
-Verden ville bestå af ensomme atomer, der ikke var i stand til at danne faste eller flydende stoffer. Dette ville også resultere i forsvinden af al transformation af stof; der vil være nogen kemisk reaktion. Bare flygtige gasser overalt.
Referencer
- Harry B. Gray. (1965). Elektroner og kemisk binding. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 233, 251, 278, 279.
- Nave R. (2016). Kemisk binding. Gendannet fra: hyperphysics.phy-astr.gsu.edu
- Kemiske bindetyper. (3. oktober 2006). Hentet fra: dwb4.unl.edu
- Dannelse af kemiske bindinger: Elektronernes rolle. [PDF]. Gendannet fra: cod.edu
- CK-12 Foundation. (s.f.). Dannelse af energi og kovalent binding. Gendannet fra: chem.libretexts.org
- Quimitube. (2012). Koordinat eller dativ kovalent binding. Gendannet fra: quimitube.com

Endnu ingen kommentarer