
Begreber og eksempler på kemisk delbarhed

Vi kan definere delbarhed i kemi som en egenskab af stof, der gør det muligt at adskille den i mindre portioner. For at forstå konceptet kan vi give et eksempel.
Hvis vi tager et brød og skærer det halvt igen og igen, vil vi nogensinde komme til en grundlæggende sagsblok, som ikke kan opdeles yderligere? Dette spørgsmål har været hos videnskabsmænd og filosoffer i tusinder af år.
Oprindelse og koncept for kemisk delbarhed
I lang tid blev det diskuteret, om stof var sammensat af partikler (hvad vi i dag kender som atomer), men den generelle idé var, at stof var et kontinuum, der kunne opdeles.
Dette udbredte koncept gjorde strålende forskere som James Clerk Maxwell (af Maxwells ligninger) og Ludwing Boltzman (af Boltzman-distribution) offer for latterliggørelse, som kørte den førstnævnte til galskab og den sidstnævnte til selvmord..
I det 5. århundrede f.Kr. brugte den græske filosof Leucippus og hans discipel Democritus ordet atomer til at betegne det mindste individuelle stykke stof og foreslog, at verden kun består af atomer i bevægelse..
Denne tidlige atomteori adskilte sig fra senere versioner, idet den omfattede ideen om en menneskelig sjæl, der består af en mere raffineret type atom fordelt i hele kroppen..
Atomteori faldt i tilbagegang i middelalderen, men blev genoplivet i begyndelsen af den videnskabelige revolution i det 17. århundrede..
Isaac Newton mente for eksempel, at stof bestod af "faste, massive, hårde, uigennemtrængelige og mobile partikler.".
Delbarheden kan forekomme ved forskellige metoder, den mest almindelige er delbarheden ved fysiske metoder, for eksempel at hugge et æble med en kniv.
Delbarhed kan dog også forekomme ved kemiske metoder, hvor stof vil blive adskilt i molekyler eller atomer.
10 eksempler på kemisk delbarhed
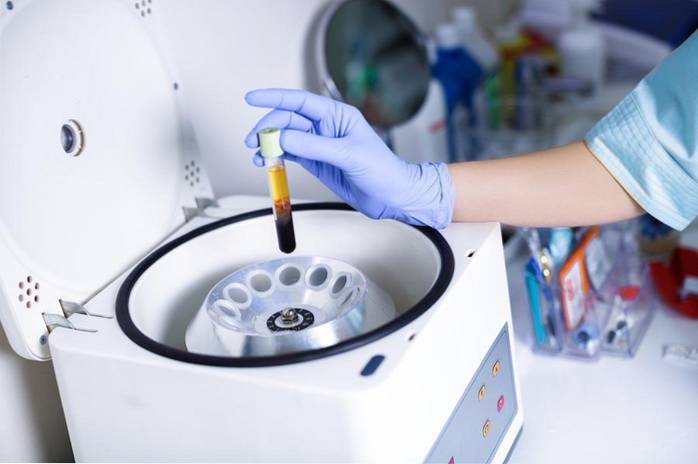
1- Opløs salt i vand
Når et salt, for eksempel natriumchlorid, opløses i vand, opstår et opløsningsfænomen, hvor saltets ioniske bindinger brydes:
NaCl → Na+ + Cl-
Ved at opløse kun et saltkorn i vand, vil det adskille sig i milliarder natrium- og chloridioner i opløsning..
2- Oxidation af metaller i et surt medium
Alle metaller, for eksempel magnesium eller zink, reagerer med syrer, for eksempel fortyndet saltsyre for at give hydrogenbobler og en farveløs opløsning af metalchloridet.
Mg + HCI → Mgto+ +Cl- + Hto
Syren oxiderer metallet og adskiller de metalliske bindinger for at opnå ioner i opløsning (BBC, 2014).
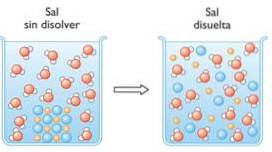
3- Hydrolyse af estere
Hydrolyse er brydningen af en kemisk binding gennem vand. Et eksempel på hydrolyse er hydrolyse af estere, hvor disse er opdelt i to molekyler, en alkohol og en carboxylsyre..
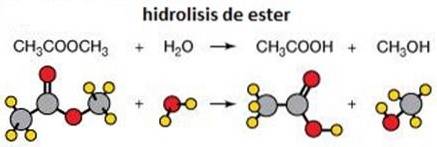
4- Elimineringsreaktioner
En eliminationsreaktion gør nøjagtigt hvad den siger: den fjerner atomer fra et molekyle. Dette gøres for at skabe en kulstof-kulstof dobbeltbinding. Dette kan gøres ved hjælp af en base eller en syre.
Det kan forekomme i et enkelt samordnet trin (abstraktion af protonen ved Ca, der forekommer på samme tid som spaltningen af Cβ-X-bindingen) eller i to trin (spaltning af Cβ-X-bindingen sker først for at danne et mellemprodukt carbocation, som derefter "slukker" ved abstraktion af protonen i alfa-carbon).
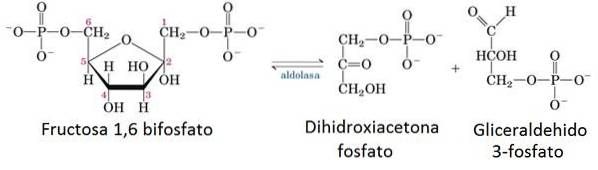
5- Enzymatisk reaktion af aldolase
I den præparative fase af glykolyse opdeles et glukemolekyle i to molekyler glyceraldehyd-3-phosphat (G3P) under anvendelse af 2 ATP.
Enzymet, der har ansvaret for dette snit, er aldolase, som gennem omvendt kondensation deler i to fructose-1,6-bisphosphatmolekylet i et G3P-molekyle og et dihydroxyacetonphosphatmolekyle, der senere isomeriseres til dannelse af et andet G3P-molekyle.
6- Nedbrydning af biomolekyler
Ikke kun glykolyse, men al nedbrydning af biomolekyler i kataboliseringsreaktioner er eksempler på kemisk delbarhed.
Dette skyldes, at de starter fra store molekyler såsom kulhydrater, fedtsyrer og proteiner for at producere mindre molekyler såsom acetyl CoA, der kommer ind i Krebs-cyklussen for at producere energi i form af ATP.
7- Forbrændingsreaktioner
Dette er et andet eksempel på kemisk delbarhed, da komplekse molekyler såsom propan eller butan reagerer med ilt for at producere CO.to og vand:
C3H8 + 5Oto → 3COto + 4HtoELLER
Nedbrydningen af biomolekyler kan siges at være en forbrændingsreaktion, da de færdige produkter er COto og vand, men disse er givet i mange trin med forskellige mellemled.
8- Centrifugering af blod
Adskillelsen af de forskellige komponenter i blodet er et eksempel på delelighed. På trods af at det er en fysisk proces, virker eksemplet interessant for mig, da komponenterne adskilles ved forskel i densitet ved centrifugering.
De tætteste komponenter, serum med de røde blodlegemer, forbliver i bunden af centrifugerøret, mens de mindre tætte komponenter, plasmaet, forbliver øverst..
9- Bicarbonatbuffer
Natriumbicarbonat, HCO3- Det er den vigtigste måde at transportere CO påto i kropsproduktet af metaboliske nedbrydningsreaktioner.
Denne forbindelse reagerer med en proton i mediet for at producere kulsyre, som efterfølgende er opdelt i CO2 og vand:
HCO3- + H+ D HtoCO3 D COto + HtoELLER
Da reaktionerne er reversible, er dette en måde, som organismen gennem respiration skal kontrollere den fysiologiske pH for at undgå processer med alkalose eller acidose.
10- Opdeling af atom eller kernefission
I tilfælde af at en massiv kerne (såsom uran-235) bryder sammen (fissioner), vil det resultere i et netto energiudbytte. Dette skyldes, at summen af masserne af fragmenterne vil være mindre end massen af urankernen..
I tilfælde af at fragmenternes masse er lig med eller større end jernets ved toppen af den bindende energikurve, vil kernepartiklerne være tættere bundet end i urankernen, og dette fald i masse forekommer i energiform i henhold til til Einsteins ligning.
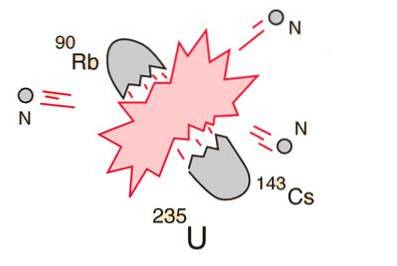
For elementer, der er lettere end jern, producerer fusion energi. Dette koncept førte til oprettelsen af atombomben og kernekraften..
Referencer
- AJ Software & Multimedia. (2015). Nuklear fission: Grundlæggende. Gendannet fra atomicarchive.com.
- (2014). Reaktioner af syrer. Gendannet fra bbc.co.uk.
- Clark, J. (2016, januar). HYDROLYSERENDE ESTRE. Gendannet fra chemguide.co.uk.
- Foist, L. (S.F.). Eliminationsreaktioner i organisk kemi. Gendannet fra study.com.
- Miller, W. A. (1867). Elementer i kemi: Teoretisk og praktisk, del 1. New York: John Wiley og søn.
- Nuklear fission. (S.F.). Gendannet fra hyperfysik.
- Pratt, D. (1997, november). Den uendelige delelighed af sagen. Gendannet fra davidpratt.info.
- Soderberg, T. (2016, 31. maj). Eliminering ved hjælp af E1- og E2-mekanismerne. Gendannet fra kem.libretext.



Endnu ingen kommentarer