
Helmholtz gratis energienheder, hvordan man beregner det, løste øvelser
Det Helmholtz fri energi er et termodynamisk potentiale, der måler det nyttige arbejde i et lukket system under betingelser med konstant temperatur og volumen. Helmholtz fri energi betegnes som F y defineres som forskellen på den indre energi ELLER minus temperaturprodukt T ved entropi S:
F = U - T⋅S
Da det er energi, måles det i Joule in the International System (SI), selvom andre passende enheder også kan være ergs (CGS), kalorier eller elektronvolt (eV).

Den negative variation af Helmholtz-energien under en proces sidestilles med det maksimale arbejde, som systemet kan udføre i en isokorisk proces, det vil sige ved konstant volumen. Når lydstyrken ikke holdes konstant, kan noget af dette arbejde udføres på miljøet.
I dette tilfælde refererer vi til arbejde, hvor lydstyrken ikke varierer, såsom elektrisk arbejde: dW = Φdq, med Φ som det elektriske potentiale og q som den elektriske ladning.
Hvis temperaturen også er konstant, minimeres Helmholtz-energien, når ligevægt nås. Til alt dette er Helmholtz-energien særlig nyttig i processer med konstant volumen. I dette tilfælde har du:
- For en spontan proces: ΔF < 0
- Når systemet er i ligevægt: ΔF = 0
- I en ikke-spontan proces: ΔF> 0.
Artikelindeks
- 1 Hvordan beregnes Helmholtz fri energi??
- 1.1 Spontane processer
- 2 Løst øvelser
- 2.1 Øvelse 1
- 2.2 Øvelse 2
- 3 Referencer
Hvordan beregnes Helmholtz fri energi??
Som anført i begyndelsen er Helmholtz-energien defineret som "systemets indre energi U minus produktet af systemets absolutte temperatur T ved systemets entropi S":
F = U - T⋅S
Det er en funktion af temperatur T og volumen V. Trinene til at visualisere dette er som følger:
- Fra den første lov om termodynamik er den interne energi U relateret til entropien S i systemet og dets volumen V til reversible processer gennem følgende differentierede forhold:
dU = dQ - dW = TdS - PdV
Heraf følger, at den interne energi U er en funktion af variablerne S Y V, Dermed:
U = U (S, V)
- Nu tager vi definitionen af F og det er afledt:
dF = dU - d (TS) = dU - TdS - SdT
- Ved at erstatte der det differentielle udtryk, der er opnået for dU i det første trin, forbliver det:
dF = TdS - PoV - TdS - SdT = -SdT - PoV
- Endelig konkluderes det, at F er en funktion af temperaturen T og lydstyrken V og kan udtrykkes som:
F = F (T, V)
Spontane processer
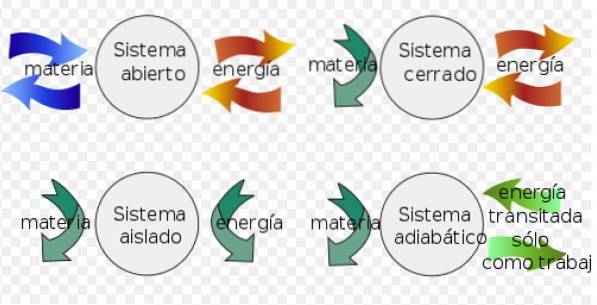
Helmholtz-energien kan anvendes som et generelt kriterium for spontanitet i isolerede systemer, men først er det praktisk at specificere nogle begreber:
- EN systemet lukket kan udveksle energi med miljøet, men kan ikke udveksle stof.
- I stedet for en isoleret system udveksler ikke stof eller energi med miljøet.
- Endelig en åbent system udveksle stof og energi med miljøet.
I reversible processer beregnes variationen af intern energi som følger:
dU = TdS - PoV
Antag nu en proces med konstant volumen (isokorisk), hvor den anden sigt i det forrige udtryk ikke har noget bidrag. Det skal også huskes, at ifølge Clausius ulighed:
dS ≥ dQ / T
En sådan ulighed gælder for et isoleret termodynamisk system.
Så for en proces (reversibel eller ej), hvor lydstyrken forbliver konstant, gælder følgende:
T dS ≥ dU (ved fast lydstyrke)
Under hensyntagen til, at:
dF = dU - T dS
Vi vil have, at det i en isokorisk proces ved konstant temperatur er tilfreds med: dF ≤ 0, som angivet i starten.
Så Helmholtz-energien F er en faldende mængde i en spontan proces, så længe det er et isoleret system. F når sin minimale og stabile værdi, når reversibel ligevægt er nået.
Løst øvelser
Øvelse 1
Beregn variationen af Helmholtz fri energi F for 2 mol ideel gas ved en temperatur på 300 K under en isoterm ekspansion, der fører systemet fra et indledende volumen på 20 liter til et slutvolumen på 40 liter.
Opløsning
Startende med definitionen af F:
F = U - T S
Derefter vil en endelig variation af F, kaldet ΔF, være:
ΔF = ΔU - T ΔS
Da erklæringen siger, at temperaturen er konstant: AT = 0. Nu, i ideelle gasser, afhænger den indre energi kun af deres absolutte temperatur, men da det er en isoterm proces, da ΔU = 0 Y ΔF = - T ΔS. For ideelle gasser skrives entropiændringen af en isoterm proces således:
AS = n.R.ln (V.to/ V1)
Anvendelse af dette udtryk:
ΔS = 2 mol x 8,314 J / (K mol) x ln (40L / 20L) = 11,53 J / K
Endelig er ændringen i Helmholtz energi:
ΔF = - T ΔS = - 300 K x 11,53 J / K = -3457,70 J.
Øvelse 2
Inde i en cylinder er der et stempel, der deler det i to sektioner, og på hver side af stemplet er der n mol af en monatomisk idealgas som vist i nedenstående figur.
Cylindervæggene er gode varmeledere (diatermiske) og er i kontakt med et reservoir med temperatur Teller.
Det indledende volumen for hver af cylindersektionerne er V1i og V2i, mens dens endelige volumener er V1f og V2f efter kvasistatisk forskydning. Stemplet bevæges ved hjælp af et stempel, der hermetisk passerer gennem de to cylinderhætter.
Det bliver bedt om at finde:
a) Ændringen i den interne energi i gassen og det arbejde, der udføres af systemet og
b) Variationen af Helmholtz-energien.
Løsning til
Da stemplet bevæger sig kvasistatisk, skal den ydre kraft, der påføres stemplet, afbalancere kraften på grund af trykforskellen i de to sektioner af cylinderen..
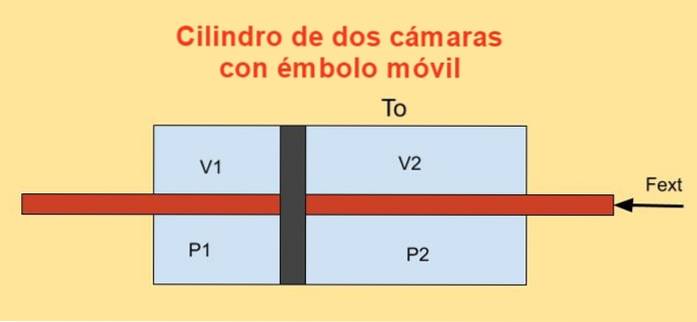
Jobbet dW udført af ekstern kraft Fekst under et uendeligt minimalt skift dx det er:
dW = - F.ekst dx = (P1 - Pto) a dx = P1 dV1 + Pto dVto
Hvor forholdet er blevet brugt dV1 = - dVto = en dx, være til stemplet. På den anden side er variationen af Helmholtz-energien:
dF = -SdT - PdV
Da temperaturen ikke ændrer sig under processen, så dT = 0 Y dF = - PoV. Anvendelse af dette udtryk på hver sektion af cylinderen har vi:
dW = P1 dV1 + Pto dVto = - dF1 - dFto
At være F1 Y Fto Helmholtz-energierne i hvert af kamrene.
Det endelige arbejde W kan beregnes ud fra den endelige variation af Helmholtz-energien i hvert kammer:
W = -AF1 - ΔFto
Løsning b
For at finde ændringen i Helmholtz energi anvendes definitionen: F = U - T S. Som i hvert kammer er der en monatomisk ideel gas ved konstant temperatur Teller, den indre energi ændres ikke (ΔU = 0), således at: ΔF = - Teller AS. Hvad mere er:
ΔS = nR ln (V.F/Sav)
At når man udskifter endelig tillader det udførte arbejde at være:
W = -Teller nR ln (V1f / V1i) -To nR ln (V2f / V2i) = -ΔF1 -ΔFto
W = - Til nR ln [(V1f ⋅ V1i) / (V2f .V2i)] = - ΔFTotal
At være ΔFTotal den samlede ændring i Helmholtz energi.
Referencer
- Kastanjer E. Gratis energiøvelser. Gendannet fra: lidiaconlaquimica.wordpress.com
- Libretexts. Helmholtz Energy. Gendannet fra: chem.libretexts.org
- Libretexts. Hvad er gratis energier. Gendannet fra: chem.libretexts.org
- Wikipedia. Helmholtz energi. Gendannet fra: es.wikipedia.com
- Wikipedia. Helmholtz fri energi. Gendannet fra: en.wikipedia.com



Endnu ingen kommentarer