
Link Pi Hvordan det dannes, egenskaber og eksempler
EN pi-link (π) er en type kovalent binding, der er kendetegnet ved at forhindre den frie rotationsbevægelse af atomer og ved at stamme mellem et par atomorbitaler af ren type, blandt andre særegenheder. Der er bindinger, der kan dannes mellem atomer af deres elektroner, som giver dem mulighed for at bygge større og mere komplekse strukturer: molekyler.
Disse bindinger kan være af forskellige varianter, men de mest almindelige inden for dette felt er kovalenterne. Kovalente bindinger, også kaldet molekylære bindinger, er en type binding, hvor de involverede atomer deler par af elektroner.
Dette kan forekomme på grund af atomernes behov for at søge stabilitet og således danne de fleste af de kendte forbindelser. I denne forstand kan kovalente bindinger være enkelt, dobbelt eller tredobbelt, afhængigt af konfigurationen af deres orbitaler og antallet af par elektroner delt mellem de involverede atomer..
Dette er grunden til, at der er to typer kovalente bindinger, der dannes mellem atomer baseret på orienteringen af deres orbitaler: sigma (σ) bindinger og pi (π) bindinger..
Det er vigtigt at differentiere begge bindinger, da sigma-bindingen forekommer i enkle bindinger og pi i flere bindinger mellem atomer (to eller flere elektroner deles).
Artikelindeks
- 1 Hvordan dannes det??
- 1.1 Dannelse af pi-bindinger i forskellige kemiske arter
- 2 funktioner
- 3 eksempler
- 4 Referencer
Hvordan er det dannet?
For at beskrive dannelsen af pi-bindingen skal hybridiseringsprocessen først diskuteres, da den griber ind i nogle vigtige bindinger..
Hybridisering er en proces, hvor hybrid elektroniske orbitaler dannes; det vil sige hvor s og p atomare subniveau orbitaler kan blandes. Dette forårsager dannelsen af sp, sp orbitalerto og sp3, som kaldes hybrider.
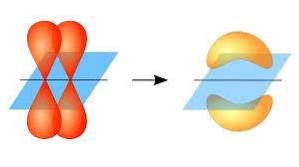
I denne forstand opstår dannelsen af pi-bindinger takket være overlapningen af et par lapper, der tilhører en atombane på et andet par lapper, der er i en orbitale, der er en del af et andet atom..
Denne orbital overlapning forekommer lateralt, hvorved den elektroniske distribution hovedsagelig er koncentreret over og under det plan, der dannes af de bundne atomkerner, og får pi-bindingerne til at være svagere end sigma-bindingerne..
Når vi taler om orbital symmetri af denne type union, skal det nævnes, at den er lig med p-typen orbitaler, så længe den observeres gennem aksen dannet af bindingen. Desuden består disse fagforeninger for det meste af p-orbitaler..
Dannelse af pi-bindinger i forskellige kemiske arter
Da pi-bindinger altid ledsages af en eller to flere bindinger (en sigma eller en anden pi og en sigma), er det relevant at vide, at dobbeltbindingen, der dannes mellem to carbonatomer (består af en sigma og en pi-binding) har lavere bindingsenergi end den, der svarer til to gange sigma-bindingen mellem de to.
Dette forklares med stabiliteten af sigma-bindingen, som er større end pi-bindingens, fordi overlapningen af atomorbitaler i sidstnævnte forekommer på en parallel måde i regionerne over og under loberne og akkumulerer den elektroniske distribution i en mere fjern fjernelse af atomkerner.
På trods af dette, når pi- og sigma-bindinger kombineres, dannes der en stærkere multipelbinding end selve enkeltbindingen, som kan verificeres ved at observere bindingslængderne mellem forskellige enkelt- og multiple bindingsatomer..
Der er nogle kemiske arter, der undersøges for deres usædvanlige opførsel, såsom koordineringsforbindelser med metalliske elementer, hvor de centrale atomer kun er forbundet med pi-bindinger..
Egenskaber
De egenskaber, der adskiller pi-bindinger fra andre former for interaktioner mellem atomarter, er beskrevet nedenfor, begyndende med det faktum, at denne binding ikke tillader fri rotationsbevægelse af atomer, såsom kulstof. Af denne grund, hvis der er rotation af atomerne, brydes bindingen..
Ligeledes finder overlapningen mellem orbitalerne sted i to parallelle regioner i disse forbindelser og opnår, at de har en større diffusion end sigma-linkene, og at de af denne grund er svagere..
På den anden side, som nævnt ovenfor, genereres pi-bindingen altid mellem et par rene atomorbitaler; Dette betyder, at den genereres mellem orbitaler, der ikke har gennemgået hybridiseringsprocesser, hvor elektronernes massefylde hovedsagelig er koncentreret over og under det plan, der dannes af den kovalente binding..
I denne forstand kan der mellem et par atomer være mere end en pi-binding, der altid ledsages af en sigma-binding (i dobbeltbindingerne).
Tilsvarende kan der være en tredobbelt binding mellem to tilstødende atomer, som er dannet af to pi-bindinger i positioner, der danner plan vinkelret på hinanden og en sigma-binding mellem begge atomer..
Eksempler
Som tidligere nævnt har molekyler, der består af atomer forbundet med en eller flere pi-bindinger, altid flere bindinger; dvs. dobbelt eller tredobbelt.
Et eksempel på dette er ethylenmolekylet (HtoC = CHto), som består af en dobbeltbinding; det vil sige en pi og en sigma-binding mellem deres kulstofatomer, ud over sigma-bindingerne mellem kulstofferne og hydrogenerne.
For sin del har acetylenmolekylet (H-C2C-H) en tredobbelt binding mellem dets carbonatomer; det vil sige to pi-bindinger, der danner vinkelrette planer og en sigma-binding ud over deres tilsvarende carbon-hydrogen-sigma-bindinger.
Pi-bindinger forekommer også mellem cykliske molekyler, såsom benzen (C6H6) og dets derivater, hvis arrangement resulterer i en effekt kaldet resonans, som gør det muligt for elektrondensiteten at migrere mellem atomer og blandt andet give forbindelsen større stabilitet..
For at eksemplificere de tidligere nævnte undtagelser er tilfældene med dicarbonmolekylet (C = C, hvor begge atomer har et par parrede elektroner) og koordinationsforbindelsen kaldet hexacarbonyljern (repræsenteret som Feto(CO)6, som kun er dannet af pi-bindinger mellem dets atomer).
Referencer
- Wikipedia. (s.f.). Pi-bånd. Gendannet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende udgave. Mexico: McGraw-Hill.
- ThoughtCo. (s.f.). Pi Bond-definition i kemi. Gendannet fra thoughtco.com
- Britannica, E. (s.f.). Pi-bånd. Hentet fra britannica.com
- LibreTexts. (s.f.). Sigma og Pi obligationer. Gendannet fra chem.libretexts.org
- Srivastava, A. K. (2008). Organisk kemi lavet enkel. Gendannet fra books.google.co.ve



Endnu ingen kommentarer