
Sigma Link Hvordan det dannes, egenskaber og eksempler
Det sigma link (repræsenteret som σ) er en kovalent type union, der er karakteriseret ved deling af to elektroner, der forekommer mellem et par atomer for at danne bindingen. Derudover er dette en slags enkeltbinding, hvor begge atomer er bundet af to elektroner for at danne en enkeltbinding..
Når to eller flere atomer kombineres for at give anledning til nye molekylære forbindelser, forbindes de ved hjælp af to typer bindinger: ionisk og kovalent, hvis struktur afhænger af, hvordan elektronerne deles mellem begge atomer, der er involveret i denne kobling..
Forbindelsen genereret gennem elektronerne udføres takket være overlapningen af de orbitaler, der hører til hvert atom (ved deres ender), idet de som orbitaler forstå de rum, hvor det mest sandsynligt er at lokalisere elektronen i atomet, og som er defineret af elektron massefylde.
Artikelindeks
- 1 Hvordan dannes det??
- 1.1 Dannelse af sigma-bindinger i forskellige kemiske arter
- 2 funktioner
- 3 eksempler
- 4 Referencer
Hvordan er det dannet?
Typisk er enkeltbindingen mellem to atomer kendt for at være ækvivalent med en enkelt sigma-binding..
Ligeledes stammer disse bindinger på grund af overlejring eller overlapning på en frontal måde, der opstår mellem enderne af atomorbitalerne i to forskellige atomer..
Disse atomer, hvis orbitaler overlapper hinanden, skal være ved siden af hinanden, så de individuelle elektroner, der hører til hver atombane, effektivt kan binde og danne bindingen..
Derfor er det faktum, at den elektroniske distribution, der manifesterer sig eller placeringen af elektronernes tæthed fra hver superposition, har en cylindrisk symmetri omkring aksen, der forekommer mellem de to sammenkædede atomarter..
I dette tilfælde kan den såkaldte sigma-orbitale lettere udtrykkes i form af intramolekylære bindinger, der dannes i diatomiske molekyler, idet der bemærkes, at der også er flere typer sigma-bindinger..
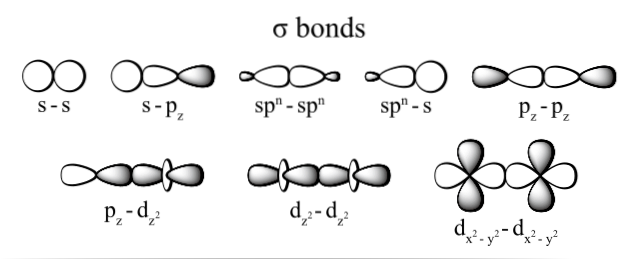
De mest observerede typer sigma-binding er: dzto+dzto, s + sz, sz+sz og s + s; hvor tegnet z repræsenterer aksen, der udgøres af den dannede binding, og hvert bogstav (s, p og d) svarer til en orbital.
Dannelse af sigma-bindinger i forskellige kemiske arter
Når vi taler om molekylære orbitaler, henvises der til de regioner, der akkumulerer den højeste elektrondensitet, når en binding af denne type dannes mellem forskellige molekyler, der opnås gennem kombinationen af atomorbitaler..
Fra kvantemekanikens synspunkt har undersøgelser udledt, at orbitaler af molekylær type, der udviser symmetrisk lige opførsel, faktisk kombineres i blandinger (hybridiseringer).
Imidlertid er betydningen af denne kombination af orbitaler tæt knyttet til de relative energier manifesteret af orbitaler af molekylær type, der er symmetrisk ens..
I tilfælde af organiske molekyler observeres ofte cykliske arter bestående af en eller flere ringstrukturer, som ofte udgøres af et stort antal sigma-type bindinger i forbindelse med pi-type bindinger (multiple bindinger)..
Faktisk er det ved hjælp af enkle matematiske beregninger muligt at bestemme antallet af sigma-bindinger til stede i en molekylær art..
Der er også tilfælde af koordinationsforbindelser (med overgangsmetaller), hvor flere bindinger kombineres med forskellige klasser af bindingsinteraktioner såvel som molekyler, der består af forskellige typer atomer (polyatomisk).
Egenskaber
Sigma-bindinger har unikke egenskaber, der tydeligt adskiller dem fra andre typer kovalent binding (pi-binding), blandt hvilke det faktum er, at denne type binding er den stærkeste blandt de kemiske bindinger i den kovalente klasse.
Dette skyldes, at overlapningen mellem orbitalerne sker direkte, koaksialt (eller lineært) og frontalt; der opnås en maksimal overlapning mellem orbitalerne.
Derudover er den elektroniske distribution ved disse krydsninger hovedsageligt koncentreret mellem kernerne af de atomarter, der kombineres..
Denne overlapning af sigma-orbitaler forekommer på tre mulige måder: mellem et par rene orbitaler (s-s), mellem en ren orbital og en hybrid-type (s-sp) eller mellem et par orbitaler af hybrid-typen (sp3- sp3).
Hybridisering sker takket være blandingen af orbitaler af atomær oprindelse i forskellige klasser, idet man opnår, at den resulterende hybridbane afhænger af mængden af hver af typerne af rene udgangsorbitaler (for eksempel sp3 = en ren s orbital + tre rene orbitaler af p-typen).
Ud over dette kan sigma-bindingen eksistere uafhængigt såvel som tillade fri rotationsbevægelse mellem et par atomer..
Eksempler
Da den kovalente binding er den mest almindelige form for binding mellem atomer, findes sigma-bindingen i et stort antal kemiske arter, som det kan ses nedenfor.
I diatomiske gasmolekyler - såsom brint (Hto), ilt (Otoog nitrogen (Nto) - forskellige typer bindinger kan forekomme afhængigt af hybridiseringen af atomerne.
I tilfælde af brint er der en enkelt sigma-binding, der forbinder begge atomer (HH), fordi hvert atom bidrager med sin eneste elektron.
På den anden side er molekylært ilt begge atomer forbundet med en dobbeltbinding (O = O) -det vil sige en sigma-binding og en pi-binding, hvilket efterlader hvert atom sit med tre par resterende elektroner parret.
I stedet har hvert nitrogenatom fem elektroner i sit yderste energiniveau (valensskal), så de er forbundet med en tredobbelt binding (N≡N), hvilket indebærer tilstedeværelsen af en sigma-binding og to pi-bindinger og et par parrede elektroner i hvert atom.
På samme måde forekommer det i forbindelser af cyklisk type med enkelt- eller multiple bindinger og i alle slags molekyler, hvis struktur består af kovalente bindinger..
Referencer
- Wikipedia. (s.f.). Sigma bond. Gendannet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende udgave. Mexico: McGraw-Hill.
- ThoughtCo. (s.f.). Sigma Bond Chemistry Definition. Gendannet fra thoughtco.com
- Britannica, E. (s.f.). Sigma bond. Hentet fra britannica.com
- LibreTexts. (s.f.). Sigma og Pi-obligationer. Gendannet fra chem.libretexts.org
- Srivastava, A. K. (2008). Organisk kemi lavet enkel. Gendannet fra books.google.co.ve



Endnu ingen kommentarer