
Enthalpi af reaktionsdefinition, termokemi, øvelser
Det reaktionsentalpi er en termodynamisk funktion, der tillader beregning af den varme, der er opnået eller leveret i en kemisk reaktion, forudsat at denne reaktion har fundet sted ved konstant tryk. Det defineres som den indre energi U plus produktet af trykket P ved volumen V for de stoffer, der deltager i en kemisk reaktion, som følger: H = U + P ∙ V
Derfor har entalpi dimensioner af energi, og i det internationale målesystem måles det i Joule. For at forstå forholdet mellem entalpi og den varme, der udveksles i en kemisk reaktion, er det nødvendigt at huske termodynamikens første lov, som siger følgende: Q = +U + W

Den første lov fastslår, at varmen, der udveksles i en termodynamisk proces, er lig med variationen af den indre energi af de stoffer, der er involveret i processen plus det arbejde, som de nævnte stoffer udfører i processen..
I enhver proces beregnes arbejdet W ved følgende forhold:
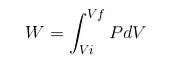
I ovenstående udtryk er Vi det indledende volumen, Vf det endelige volumen og P trykket. Hvis processen udføres ved konstant tryk P, vil det resulterende arbejde være:
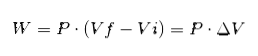
Hvor ΔV er volumenændringen.
Artikelindeks
- 1 Definition
- 2 Forhold til varme
- 3 Standard entalpi
- 4 Termokemi
- 4.1 Enthalpy er en omfattende termodynamisk mængde
- 5 Øvelser løst
- 5.1-Øvelse 1
- 5.2-Øvelse 2
- 6 Referencer
Definition
Kemiske reaktioner er termodynamiske processer, der generelt forekommer ved konstant tryk og meget ofte ved atmosfærisk tryk. Denne type termodynamiske processer kaldes "isobar", da den forekommer ved konstant tryk.
I dette tilfælde kan den første lov om termodynamik skrives således:
Qp = UU + P ∙ ΔV
Hvor Qp indikerer, at varmen er udvekslet ved konstant tryk. Hvis definitionen af entalpi H = U + P ∙ V introduceres i det foregående udtryk, får vi derefter:
Qp = Ah
Derfor indikerer en positiv entalpiændring en reaktion, der har taget varme fra miljøet. Dette er en endoterm reaktion.
Tværtimod, hvis entalpiændringen er negativ, er det en eksoterm reaktion.
Faktisk kommer ordet entalpi fra det græske ord enthalpien, hvis betydning er "at varme".
Enthalpi kaldes ofte også varme. Men det skal være klart, at det ikke er det samme som varme, men det er varmevekslingen under den termodynamiske proces, der ændrer entalpi.
Forholdet til varmen
I modsætning til varme er entalpi en funktion af tilstanden. Når entalpiændringen beregnes, beregnes forskellen mellem to funktioner, der udelukkende afhænger af systemets tilstand, såsom intern energi og volumen..
ΔH = ΔU + P ∙ ΔV
Da trykket forbliver konstant i reaktionen, er reaktionens entalpi en tilstandsfunktion, der kun afhænger af den indre energi og volumenet..
I en kemisk reaktion kan entalpi af reaktanterne defineres som summen af summen af hver af dem; og den af produkterne som summen af entalpi af alle produkter.
Entalpiændringen i en reaktion er forskellen mellem produkterne minus reaktanternes:
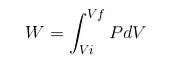
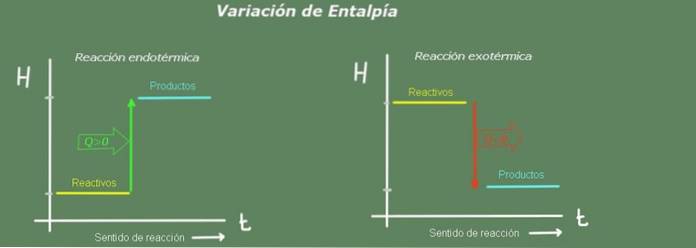
I en endoterm reaktion er produktets entalpi større end reaktanternes; det vil sige, reaktionen tager varme fra miljøet. Tværtimod, i en eksoterm reaktion er reaktantens entalpi større end for produkterne, da reaktionen giver varme op til miljøet.
Standard entalpi
Da entalpiændringen i en kemisk reaktion kan afhænge af tryk og temperatur, er det almindeligt at definere standardreaktionsbetingelser:
Standard reaktionstemperatur: 25 ° C.
Standard reaktionstryk: 1 atm = 1 bar.
Standardentalpi er betegnet således: H °
Termokemi
I en termokemisk ligning betyder ikke kun reaktanterne og produkterne noget, entalpi-variationen betyder også noget. Enthalpy forstås som reaktionen på den ændring, der fandt sted under den samme.
Lad os som et eksempel se på følgende reaktioner:
2 H2 (gas) + O2 (gas) → 2 H2O (væske); ΔH ° = -571,6 kJ (eksoterm).
H2 (gas) + (½) O2 (gas) → H2O (væske); ΔH ° = -285,8 kJ (eksoterm).
2 H2O (væske) → 2 H2 (gas) + O2 (gas); ΔH ° = +571.6 kJ (endoterm).
Enthalpy er en omfattende termodynamisk mængde
Hvis vilkårene for en kemisk ligning multipliceres eller divideres med en bestemt faktor, multipliceres entalpi eller divideres med den samme.
Hvis reaktionen vendes, vendes også tegnet på reaktionsenthalpi.
Løst øvelser
-Øvelse 1
Acetylengas C2H2 opnås ved reaktionen af calciumcarbid CaC2, der kommer i granuleret form med vand ved omgivelsestemperatur og tryk..
Som data har vi entalpierne af dannelsen af reaktanterne:
ΔH ° (CaC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
Og entalpi af dannelsen af produkterne:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (Ca (OH) 2) = -986,0 kJ / mol
Find reaktionens standardentropi.
Opløsning
Den første ting er at foreslå en afbalanceret kemisk ligning:
CaC2 (s) + 2H20 (l) → Ca (OH) 2 (s) + C2H2 (g)
Og nu entalpierne af reaktanterne, produkterne og reaktionen:
- Reagenser: -59,0 kJ / mol -2 ∙ 285,8 kJ / mol = -630,6 kJ / mol
- Produkter: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
- Reaktion: ΔH ° = -759 kJ / mol - (-630 kJ / mol) = -129 kJ / mol
Det er en eksoterm reaktion.
-Øvelse 2
Når 1 liter acetylen forbrændes under standardbetingelser, hvor meget varme afgives der?
Opløsning
Når den er afbalanceret, ser forbrændingsreaktionen af acetylen sådan ud:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (l)
Vi har brug for entalpierne for dannelsen af produkterne:
ΔH ° (C02) = -393,5 kJ / mol
ΔH ° (H20 (l)) = -285,8 kJ / mol
Beregning af entalpier
Med disse data kan vi beregne entalpi af produkterne:
ΔH ° (produkter) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
Og entalpi af dannelsen af reaktanterne:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
Reaktanternes entalpi vil være:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
Den molære reaktionsentalpi vil så være: ΔH ° (produkter) - ΔH ° (reaktanter) = -1072,8 kJ / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Enthalpi af forbrænding
Nu skal vi vide, hvor mange mol acetylen der er en liter acetylen under standardbetingelser. Til dette vil vi bruge tilstandsligningen af en ideel gas, hvorfra vi løser antallet af mol.
Antal mol n = P * V / (R * T)
P = 1 atm = 1,013 x 10⁵ Pa
V = 1 l = 1,0 x 10 ^ -3 m³
R = 8,31 J / (mol * K)
T = 25 ° C = 298,15 K
n = 0,041 mol
Forbrændingsentalpi af 1 liter acetylen er 0,041 mol * (-1299,8 kJ / mol) = -53,13 kJ
Det negative tegn indikerer, at det er en eksoterm reaktion, der afgiver 53,13 kJ = 12,69 kcal.
Referencer
- Kastanjer E. Enthalpy i kemiske reaktioner. Gendannet fra: lidiaconlaquimica.wordpress.com
- Termokemi. Enthalpi af reaktionen. Gendannet fra: recursostic.educacion.es
- Termokemi. Definition af standard reaktions entalpi. Gendannet fra: quimitube.com
- Wikipedia. Standard entalpi af reaktion. Gendannet fra: wikipedia.com
- Wikipedia. Dannelse entalpi. Gendannet fra: wikipedia.com



Endnu ingen kommentarer