
Rutherford eksperiment historie, beskrivelse og konklusioner
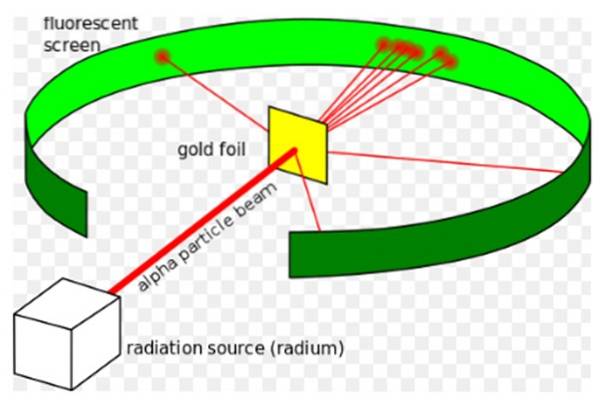
Det Rutherford eksperiment, udført mellem 1908 og 1913, bestod den af at bombardere en tynd guldfolie på 0.0004 mm tyk med alfapartikler og analysere det dispersionsmønster, som disse partikler efterlod på en fluorescerende skærm.
Faktisk udførte Rutherford adskillige eksperimenter og finjusterede detaljerne mere og mere. Efter omhyggelig analyse af resultaterne kom der to meget vigtige konklusioner:
-Atomets positive ladning er koncentreret i en region, der kaldes kerne.
-Denne atomkerne er utrolig lille sammenlignet med atomets størrelse.
Ernest Rutherford (1871-1937) var en New Zealand-født fysiker, hvis interesseområde var radioaktivitet og stofets natur. Radioaktivitet var et nylig fænomen, da Rutherford begyndte sine eksperimenter, det var blevet opdaget af Henri Becquerel i 1896.
I 1907 gik Rutherford til University of Manchester i England for at studere atomets struktur ved at bruge disse alfapartikler som sonder til at kigge ind i en så lille struktur. Fysikere Hans Geiger og Ernest Marsden fulgte ham på opgaven..
De håbede at se, hvordan en alfapartikel, som er et dobbelt ioniseret heliumatom, ville interagere med et enkelt guldatom for at sikre, at enhver afvigelse, den oplevede, kun skyldtes elektrisk kraft..
Imidlertid passerede de fleste af alfapartiklerne gennem guldfolien med kun en lille afvigelse..
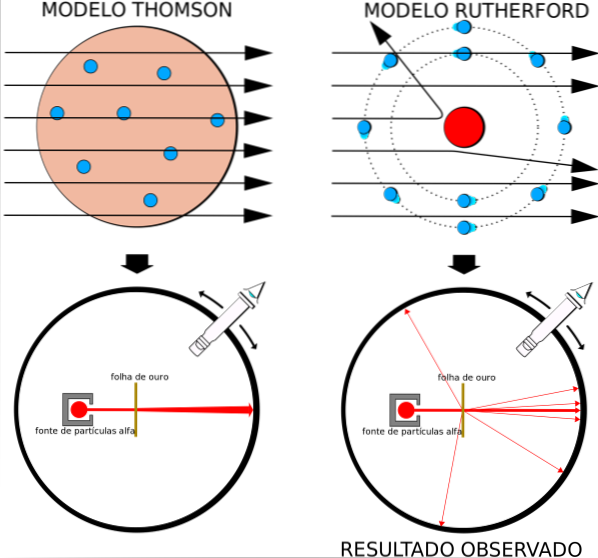
Denne kendsgerning var i fuld overensstemmelse med Thomsons atommodel, men til forskernes overraskelse oplevede en lille procentdel af alfapartiklerne en ganske bemærkelsesværdig afvigelse..
Og en endnu mindre procentdel af partikler ville komme tilbage og hoppe helt tilbage. Hvad skyldtes disse uventede resultater?
Artikelindeks
- 1 Beskrivelse og konklusioner af eksperimentet
- 1.1 Konklusioner
- 2 Indflydelser på atommodellen
- 2.1 Ulemper ved Rutherford-modellen
- 2.2 Protonen og neutronen
- 3 Hvordan er en skalamodel af hydrogenatomet?
- 4 Atommodellen i dag
- 5 Referencer
Beskrivelse og konklusioner af eksperimentet
Faktisk er alfapartiklerne, som Rutherford brugte som sonde, heliumkerner, og på det tidspunkt var det kun kendt, at disse partikler var positivt ladede. I dag er det kendt, at alfapartikler består af to protoner og to neutroner..
Alfapartikler og betapartikler var blevet identificeret af Rutherford som to forskellige slags stråling fra uran. Alfapartikler, meget mere massive end elektronen, har en positiv elektrisk ladning, mens betapartikler kan være elektroner eller positroner..
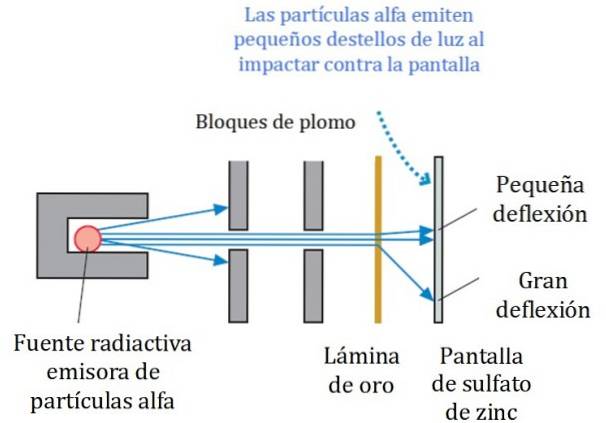
Et forenklet skema for eksperimentet er vist i figur 2. Alfa-partikelstrålen kommer fra en radioaktiv kilde. Geiger og Marsden brugte radongas som emitter.
Blyblokkene blev brugt til at rette strålingen mod guldfolien og forhindre den i at gå direkte til den fluorescerende skærm. Bly er et materiale, der absorberer stråling.
Den således rettet bjælke fik derefter til at ramme en tynd guldfolie, og de fleste af partiklerne fortsatte på vej til zinksulfat fluorescerende skærm, hvor de efterlod et lille lysspor. Geiger var ansvarlig for at tælle dem en efter en, selvom de senere designede en enhed, der gjorde det.
Det faktum, at nogle partikler gennemgik en lille afbøjning, overraskede ikke Rutherford, Geiger og Marsden. Når alt kommer til alt er der positive og negative ladninger på atomet, der udøver kræfter på alfapartiklerne, men da atomet er neutralt, hvilket de allerede vidste, måtte afvigelserne være små..
Overraskelsen ved eksperimentet er, at nogle få positive partikler blev sprunget næsten direkte tilbage..
Konklusioner
Ca. 1 ud af 8000 alfapartikler blev afbøjet i vinkler større end 90 °. Få, men nok til at stille spørgsmålstegn ved nogle ting.
Atommodellen, der var på mode, var den for rosinpudding af Thomson, Rutherfords tidligere professor ved Cavendish Laboratory, men Rutherford spekulerede på, om ideen om et atom uden en kerne og med elektroner indlejret som rosiner var korrekt..
Fordi det viser sig, at disse store afbøjninger af alfapartikler, og det faktum, at nogle få er i stand til at vende tilbage, kun kan forklares, hvis et atom har en lille, tung, positiv kerne. Rutherford antog, at kun de elektriske tiltrækkende og frastødende kræfter, som angivet af Coulombs lov, var ansvarlige for enhver afvigelse..
Når nogle af alfapartiklerne nærmer sig direkte mod denne kerne, og da den elektriske kraft varierer med afstandens inverse firkant, føler de en frastødning, der forårsager dem vidvinkelspredning eller den bagudbøjning..
For at være sikker eksperimenterede Geiger og Marsden med at bombardere ark af forskellige metaller, ikke kun guld, skønt dette metal var det mest passende for dets smidighed, for at skabe meget tynde ark..
Ved at opnå lignende resultater var Rutherford overbevist om, at den positive ladning i atomet skulle placeres i kernen og ikke spredes i hele dens volumen, som Thomson postulerede i sin model..
På den anden side, da langt størstedelen af alfapartikler passerede uden afvigelse, måtte kernen være meget, meget lille sammenlignet med atomstørrelse. Imidlertid måtte denne kerne koncentrere det meste af atomets masse.
Indflydelser på atommodellen
Resultaterne overraskede Rutherford meget, som på en konference i Cambridge erklærede: “... Det er som når du affyrer en 15-tommer kanonkugle mod et ark tissuepapir, og projektilet hopper lige mod dig og rammer dig.".
Da disse resultater ikke kunne forklares med Thomsons atommodel, foreslog Rutherford, at atomet bestod af en kerne, meget lille, meget massiv og positivt ladet. Elektronerne forblev i kredsløb omkring ham som et miniaturesolsystem.
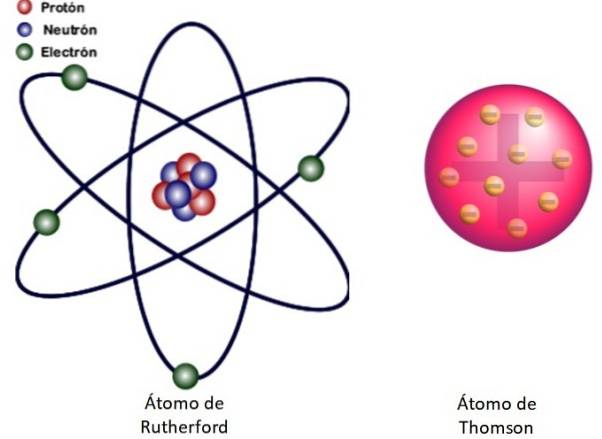
Dette er hvad kernemodellen for atomet vist i figur 3 til venstre handler om. Da elektronerne også er meget, meget små, viser det sig, at atomet er næsten alt…. tom! Derfor passerer de fleste af alfapartiklerne gennem arket knap afbøjet..
Og analogien med et miniaturesolsystem er meget nøjagtig. Atomkernen spiller Solens rolle og indeholder næsten al massen plus den positive ladning. Elektroner kredser omkring dem som planeter og bærer en negativ ladning. Enheden er elektrisk neutral.
Om fordelingen af elektroner i atomet viste Rutherfords eksperiment intet. Du tror måske, at alfapartiklerne vil have en vis interaktion med dem, men elektronernes masse er for lille, og de var ikke i stand til at afbøje partiklerne markant..
Ulemper ved Rutherford-modellen
Et problem med denne atommodel var netop elektronernes opførsel.
Hvis disse ikke var statiske, men kredsede om atomkernen i cirkulære eller elliptiske baner, ledet af elektrisk tiltrækning, ville de ende med at falde mod kernen..
Dette skyldes, at de accelererede elektroner mister energi, og hvis det sker, ville det være atomets og materiens sammenbrud..
Heldigvis er dette ikke hvad der sker. Der er en slags dynamisk stabilitet, der forhindrer kollaps. Den næste atommodel efter Rutherfords var Bohrs, som gav nogle svar på, hvorfor atomkollaps ikke forekommer.
Protonen og neutronen
Rutherford fortsatte med at lave spredningseksperimenter. Mellem 1917 og 1918 valgte han og hans assistent William Kay at bombardere gasformige nitrogenatomer med de meget energiske alfapartikler fra bismuth-214..
Han blev overrasket igen, da han opdagede brintkerner. Dette er ligningen af reaktionen, den første kunstige nukleare transmutation, der nogensinde er opnået:
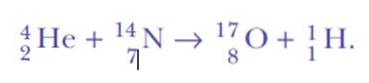
Svaret var: fra det samme kvælstof. Rutherford havde tildelt brint atomnummeret 1, fordi det er det enkleste element af alle: en positiv kerne og en negativ elektron.
Rutherford havde fundet en grundlæggende partikel, som han kaldte proton, et navn afledt af det græske ord for Først. På denne måde er protonen en essentiel bestanddel af enhver atomkerne..
Senere omkring 1920 foreslog Rutherford, at der skulle være en neutral partikel med en masse, der meget ligner protonens. Han kaldte denne partikel neutron og det er en del af næsten alle kendte atomer. Fysiker James Chadwick identificerede det endelig i 1932.
Hvordan er en skalamodel af hydrogenatomet?
Hydrogenatomet er, som vi har sagt, det enkleste af alle. Det var imidlertid ikke let at udvikle en model til dette atom..
Efterfølgende opdagelser gav anledning til kvantefysik og en hel teori, der beskriver fænomener på atomskala. Under denne proces udviklede atommodellen sig også. Men lad os se på spørgsmålet om størrelser:
Hydrogenatomet har en kerne, der består af en proton (positiv) og har en enkelt elektron (negativ).
Hydrogenatoms radius er blevet estimeret til 2,1 x 10-10 m, mens protonens er 0,85 x 10 -femten m eller 0,85 femtometre. Navnet på denne lille enhed skyldes Enrico Fermi og bruges meget, når man arbejder i denne skala.
Nå, kvotienten mellem atomens radius og kernen er i størrelsesordenen 105 m, det vil sige atomet er 100.000 gange større end kernen!!.
Det skal dog tages i betragtning, at i den moderne model, baseret på kvantemekanik, omslutter elektronen kernen i en slags sky kaldet orbital (en bane er ikke en bane), og elektronen på atomskala er ikke punktlig.
Hvis hydrogenatomet blev forstørret - fantasifuldt - til størrelsen af en fodboldbane, ville kernen bestående af en positiv proton være størrelsen på en myre i midten af feltet, mens den negative elektron ville være som en slags spøgelse , spredt over hele marken og omgiver den positive kerne.
Atommodellen i dag
Denne "planetariske" atommodel er meget indgroet og er det billede, som de fleste mennesker har af atomet, da det er meget let at visualisere. Imidlertid, Det er ikke modellen accepteret i dag inden for det videnskabelige område.
Moderne atommodeller er baseret på kvantemekanik. Hun påpeger, at elektronen i atomet ikke er en negativt ladet prik, der følger præcise baner, som dem Rutherford forestillede sig..
Snarere er elektronen det spredt i zoner, omkring den positive kerne, kaldet atomorbitaler. Fra ham kan vi vide sandsynlighed at være i en eller anden tilstand.
På trods af dette repræsenterede Rutherfords model et enormt fremskridt i forståelsen af atomets indre struktur. Og det banede vejen for, at flere forskere fortsatte med at forfine det..
Referencer
- Andriessen, M. 2001. HSC-kursus. Fysik 2. Jacaranda HSC Science.
- Arfken, G. 1984. Universitetsfysik. Akademisk presse.
- Knight, R. 2017. Fysik for forskere og teknik: en strategi tilgang. Pearson.
- Fysik OpenLab. Rutherford-Geiger-Marsden-eksperimentet. Gendannet fra: physicsopenlab.org.
- Rex, A. 2011. Grundlæggende om fysik. Pearson.
- Tyson, T. 2013. Rutherford Scattering Experiment. Hentet fra: 122.physics.ucdavis.edu.
- Xaktly. Rutherfords eksperimenter. Gendannet fra: xaktly.com.
- Wikipedia. Rutherfords eksperiment. Gendannet fra: es.wikipedia.org.



Endnu ingen kommentarer