
Semiudviklet formel hvad det er og eksempler (metan, propan, butan ...)

Det semi-udviklet formel, Også kendt som den semi-strukturelle formel, det er en af de mange mulige repræsentationer, der kan gives til molekylet af en forbindelse. Det er meget tilbagevendende inden for organisk kemi, især i akademiske tekster, da det viser den korrekte rækkefølge af et molekyle og dets kovalente bindinger.
I modsætning til den udviklede formel, som er den samme som strukturformlen, viser denne ikke C-H-bindingerne og udelader dem for at forenkle repræsentationen. Fra denne formel vil enhver læser være i stand til at forstå, hvad rygraden i et molekyle er; men ikke dens geometri eller nogen af de stereokemiske aspekter.
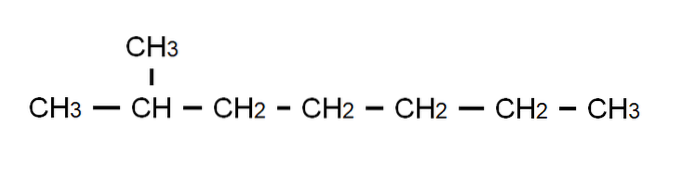
For at afklare dette punkt har vi over den semi-udviklede formel 2-methylheptan: en forgrenet alkan, hvis molekylformel er C8H18, og som adlyder den generelle formel CnH2n + 2. Bemærk, at molekylformlen absolut ikke siger noget om strukturen, mens den semi-udviklede formel allerede giver os mulighed for at visualisere, hvordan denne struktur er..
Bemærk også, at C-H-bindingerne er udeladt, og kun fremhæver de C-C-bindinger, der udgør carbonkæden eller skeletet. Det vil ses, at for simple molekyler falder den udviklede formel sammen med den kondenserede formel; og endda med molekylæret.
Artikelindeks
- 1 Eksempler
- 1.1 Metan
- 1.2 Propan
- 1.3 Butan
- 1.4 Pentan
- 1,5 Ethanol
- 1.6 Dimethylether
- 1.7 Cyclohexan
- 1.8 Fosforsyre
- 2 Generel kommentar
- 3 Referencer
Eksempler
Metan
Molekylformlen for methan er CH4, da den har fire CH-bindinger og har tetraedrisk geometri. Disse data leveres af strukturformlen med kiler uden for eller under planet. For metan bliver den kondenserede formel også CH4, såvel som det empiriske og semi-udviklede. Dette er den eneste forbindelse, for hvilken denne unikhed er opfyldt..
Årsagen til, at den semi-udviklede formel for metan er CH4, det er fordi deres CH-obligationer ikke er skrevet; dette ville svare til strukturformlen.
Propan
Den semi-udviklede formel for propan er CH3-CHto-CH3, har kun to C-C obligationer. Dets molekyle er lineært, og hvis du bemærker det, er dets kondenserede formel nøjagtigt den samme: CH3CHtoCH3, den eneste forskel er, at C-C obligationer udelades. For propan er det rigtigt, at både den halvudviklede og den kondenserede formel falder sammen.
Faktisk gælder dette for alle alkaner med lineær kæde, som det fortsat ses i de følgende afsnit.
Butan
Den semi-udviklede formel af butan er CH3-CHto-CHto-CH3. Bemærk, at det kan skrives på samme linje. Denne formel svarer strengt taget til n-butan, hvilket indikerer, at det er den lineære og uforgrenede isomer. Den forgrenede isomer, 2-methylpropan, har følgende semi-udviklede formel:
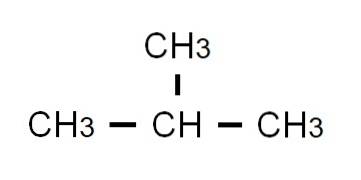
Denne gang kan det ikke længere skrives eller repræsenteres på samme linje. Disse to isomerer har samme molekylformel: C4H10, som ikke tjener til at diskriminere hinanden.
Pentan
Igen har vi en anden alkan: pentan, hvis molekylformel er C5H12. Den semi-udviklede formel af n-pentan er CH3-CHto-CHto-CHto-CH3, let at repræsentere og fortolke uden behov for at placere C-H-links. CH-grupper3 kaldes methyl eller methyl, og CHto er methylener.
Pentan har andre forgrenede strukturelle isomerer, som kan ses i det nederste billede repræsenteret af deres respektive semi-udviklede formler:
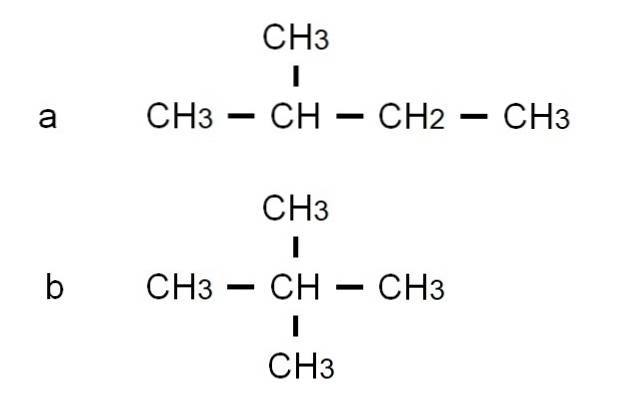
Isomeren til er 2-methylbutan, også kaldet isopentan. I mellemtiden er isomeren b er 2,2-dimethylpropan, også kendt som neopentan. Dens semi-udviklede formler gør forskellen mellem de to isomerer tydelige; Men det siger ikke meget om, hvordan sådanne molekyler ville se ud i rummet. Til dette ville strukturelle formler og modeller være nødvendige.
Ethanol
Semi-udviklede formler anvendes ikke kun til alkaner, alkener eller alkyner, men til enhver form for organisk forbindelse. Således har ethanol, en alkohol, den semi-udviklede formel: CH3-CHto-OH. Bemærk, at en C-O-binding nu er repræsenteret, men ikke en O-H-binding. Alle hydrogenbindinger forsømmes.
Lineære alkoholer er lette at repræsentere, ligesom alkaner. Kort sagt: alle semi-udviklede formler til lineære molekyler er lette at skrive.
Dimethylether
Ethers kan også repræsenteres med semi-udviklede formler. For tilfældet med dimethylether, hvis molekylformel er CtoH6Eller den semi-udviklede bliver: CH3-O-CH3. Bemærk, at dimethylether og ethanol er strukturelle isomerer, da de har den samme molekylformel (tæl C-, H- og O-atomer).
Cyclohexan
Semi-udviklede formler for forgrenede forbindelser er mere kedelige at repræsentere end lineære; men endnu mere er cykliske forbindelser, såsom cyclohexan. Dens molekylformel svarer til det samme som for hexen og dets strukturelle isomerer: C6H12, da den sekskantede ring tæller som en umættethed.
For at repræsentere cyclohexan trækkes en sekskantet ring ved hvis hjørner methylengrupperne vil være placeret, CHto, lige som set nedenfor:
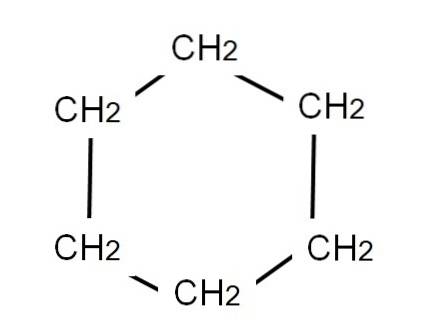
Den udviklede formel af cyclohexan ville vise C-H-bindinger, som om ringen havde tv-"antenner".
Fosforsyre
Molekylformlen af phosphorsyre er H3PO3. For mange uorganiske forbindelser er molekylformlen tilstrækkelig til at give dig en idé om strukturen. Men der er flere undtagelser, og dette er en af dem. Med det faktum, at H3PO3 er en diprotinsyre, den semi-udviklede formel er: HPO (OH)to.
Det vil sige, at et af hydrogenerne er direkte bundet til det fosforatom. Formlen H3PO3 tillader også et molekyle med semi-udviklet formel: PO (OH)3. Begge er faktisk det, der er kendt som tautomerer.
Halvudviklede formler i uorganisk kemi ligner meget kondenseret i organisk kemi. I uorganiske forbindelser, fordi de ikke har CH-bindinger, og fordi de i princippet er enklere, er deres molekylformler normalt nok til at beskrive dem (når de er kovalente forbindelser).
Generel kommentar
Semiudviklede formler er meget almindelige, når den studerende lærer nomenklaturens regler. Men når de først er assimileret, er kemiske noter fyldt med strukturformler af skelet-type; det vil sige, ikke kun er C-H-linkene udeladt, men tid spares også ved at ignorere C.
For resten er kondenserede formler mere tilbagevendende inden for organisk kemi end halvudviklede, da førstnævnte ikke engang behøver at skrive linkene som i sidstnævnte. Og når det kommer til uorganisk kemi, er disse semi-udviklede formler mindre udbredt..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2020). Halvudviklet formel. Gendannet fra: es.wikipedia.org
- Siyavula. (s.f.). Organiske molekylære strukturer. Gendannet fra: siyavula.com
- Jean Kim og Kristina Bonnett. (5. juni 2019). Tegning af organiske strukturer. Kemi Libretexts. Gendannet fra: chem.libretexts.org
- Lærere. MARL og JLA. (s.f.). Introduktion til kulstofforbindelser. [PDF]. Gendannet fra: ipn.mx


Endnu ingen kommentarer