
GLUT4 karakteristika, struktur, funktioner
GLUT4 Det er et glukosetransportørprotein med 509 aminosyrer, der har en høj affinitet for dette sukker. Det hører til den store hovedfamilie af facilitatorer (MSF), der er karakteriseret ved at have 12 transmembrane alfa-helices. Som alle medlemmer af denne familie formidler den den lette transport af glukose til fordel for dens koncentrationsgradient..
Dens placering er begrænset til celler, der er følsomme over for insulinstimulering, såsom adipocytter og myocytter. I denne forstand stjernes GLUT4 i den primære mekanisme for glucoseabsorption under betingelser med hyperglykæmi i blodet..
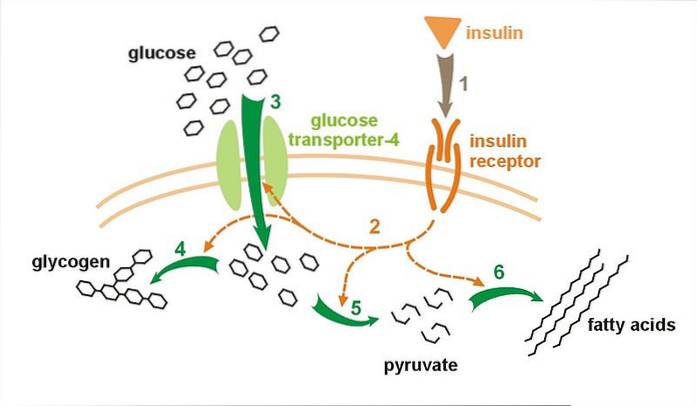
Ca. 95% af GLUT4, der er syntetiseret af cellen, forbliver i cytosolen i vesiklerne. Disse vesikler smelter sammen med plasmamembranen og udsætter receptoren deri som reaktion på aktivering af insulin-medieret exocytose..
Skeletmuskeltræning er også i stand til at fremme flytningen af denne transportør i cellemembranen i betragtning af det høje energibehov, som disse celler har under disse forhold. Imidlertid er signalerne, der stimulerer dens syntese under langvarig fysisk aktivitet, stadig ukendte..
Artikelindeks
- 1 Funktioner
- 2 Struktur
- 2.1 Hvordan sker glukostransport gennem GLUT4?
- 3 funktioner
- 3.1 Mobilisering af GLUT4-vesikler fra cytosolen til membranen
- 4 Referencer
Egenskaber
Ligesom den konstitutive ekspressionstransportør GLUT1 har GLUT4 en høj affinitet for glucose, hvilket oversættes til en evne til at binde glucose, selv når koncentrationen af dette sukker i blodet når meget lave værdier.
I modsætning til de isoformer, der er ansvarlige for glukosetransport under basale forhold (GLUT1 og GLUT3), udtrykkes denne transportør ikke i den embryonale cellemembran..
Tværtimod udtrykkes det kun i celler i voksenvæv, hovedsageligt i perifere væv, der er rige på høje koncentrationer af brunt fedt såsom hjerte, skeletmuskulatur og fedtvæv. Imidlertid er det også blevet påvist i cellerne i hypofysen og hypothalamus.
I denne forstand er det vigtigt at fremhæve, at dets distribution begrænset til celler, der er følsomme over for variationer i insulinkoncentrationer, er relateret til det faktum, at det præsenterer reguleret ekspression af dette hormon. Andre undersøgelser har vist, at muskelsammentrækning også er i stand til at udøve en regulerende effekt på ekspressionen af denne transportør..
På den anden side har subcellulære placeringsundersøgelser vist, at GLUT2 har en dobbelt placering mellem cytosolen og membranen. I det cytosoliske rum, hvor den højeste procentdel er placeret, ligger det i forskellige rum: i trans-golgi-netværket, det tidlige endosom, vesikler overtrukket eller ikke af clathrin og tubulovesikulære cytoplasmatiske strukturer.
Struktur
Som alle medlemmer af familien af glukosetransportører, der er involveret i den lette passive transport af denne hexose (GLUT'er), er GLUT4 et a-helix multipass transmembranprotein.
12 transmembransegmenter i α-helix-konfiguration krydser plasmamembraner og subcellulære rum (vesikler) af celler, hvor GLUT 4 udtrykkes.
Helices 3, 5, 7 og 11 er rumligt fordelt for at give anledning til dannelsen af en hydrofil kanal, gennem hvilken monosaccharidets transit sker fra det ekstracellulære rum til cytosolen til fordel for en koncentrationsgradient..
Proteinets amino- og carboxylterminer er orienteret mod cytoplasmaet i en konformationskonfiguration, der giver anledning til dannelsen af en stor central sløjfe.
Området afgrænset af begge ender repræsenterer en funktionelt vigtig region af proteinet, da det er involveret i både glukoseoptagelse og binding og i reaktionen på insulinsignalering. Ud over dets dirigering fra de cytosoliske vesikulære rum til plasmamembranen, hvor den vil udøve sin funktion som en transportør.
Hvordan sker glukostransport gennem GLUT4?
Som alle medlemmer af familien af glukosetransportører, der er involveret i den lette passive transport af denne hexose (GLUTs), er GLUT4 et multipass transmembranprotein i α-helix.
En deformation af strukturen induceret af sukkers binding mobiliserer bindingsstedet fra membranens ydre matrice til cytosolen, hvor det frigives. Når dette er sket, får transportøren sin oprindelige konformation igen og udsætter stedet således for glukose på den ydre overflade af membranen..
Funktioner
Glukosetransportørproteinet af GLUT4-typen er ansvarlig for at udføre mobilisering af glukose fra det ekstracellulære medium til cytosolen som reaktion på den stimulus, der genereres af den forbedrede sekretion af insulin i celler i væv, der er følsomme over for dette hormon, såsom dem, der integrere skeletmuskulatur og fedtvæv.
For bedre at forstå dette er det vigtigt at huske, at insulin er et hormon, der frigøres af β-cellerne i bugspytkirtlen som reaktion på høje koncentrationer af glukose i blodet, hvilket sætter i gang fysiologiske mekanismer, der fremmer dets absorption af celler såvel som syntesen af glykogen..
I betragtning af følsomheden af GLUT4 over for dette hormon fungerer det som hovedpersonen i den primære reguleringsmekanisme for glucoseabsorption. Spiller en nøglerolle i den hurtige mobilisering af glukose fra blodet, når monosaccharidkoncentrationer når meget høje værdier. Sidstnævnte er afgørende for at opretholde cellehomeostase.
Denne hurtige absorption af glukose er mulig på grund af den høje affinitet, som denne transportør har for dette sukker. Med andre ord er det i stand til at detektere det selv ved lave koncentrationer, hurtigt binde eller fange det..
På den anden side forklarer evnen til at detektere glukose ved lave koncentrationer vigtigheden af GLUT4-ekspression i skeletmuskelmembraner under træning, en aktivitet der har et højt energibehov.
GLUT4-vesikelmobilisering fra cytosol til membran
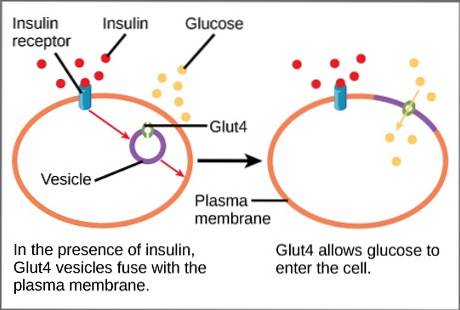
I fravær af insulinstimulering rekrutteres ca. 95% af GLUT4 til cytoplasmaet i vesikler fra trans Golgi-netværket..
Når glukosekoncentrationer langt overstiger den fysiologiske værdi, udløses en signalkaskade, der fører til frigivelse af insulin fra bugspytkirtlen.
Det frigivne insulin er nu i stand til at binde til insulinreceptoren til stede på myocyter og adipocyters membran og sende de nødvendige signaler for at udløse aktivering af exocytose. Sidstnævnte resulterer i fusion af GLUT4-bærende vesikler med plasmamembranen..
Denne fusion forøger kortvarigt koncentrationen af transportøren i membranen i disse celler. Når blodsukkerniveauet falder til baseline, forsvinder stimulusen, og transportøren genbruges ved aktivering af endocytose..
Referencer
- Bryant NJ, Govers R, James DE. Reguleret transport af glukosetransportøren GLUT4. Nat Rev Mol Cell Biol.2002; 3 (4): 267-277.
- Henriksen EJ. Inviteret gennemgang: Effekter af akut træning og træning på insulinresistens. J Appl Physiol (1985). 2002; 93 (2): 788-96.
- Huang S, tjekkisk parlamentsmedlem. GLUT4-glukostransportøren. Celle Metab. 2007; 5 (4): 237-252.
- Kraniou Y, Cameron-Smith D, Misso M, Collier G, Hargreaves M. Effekter af træning på GLUT4 og glykogeninekspression i human skeletmuskulatur. J Appl Physiol (1985). 2000; 88 (2): 794-6.
- Pessin JE, Thurmond DC, Elmendorf JS, Coker KJ, Okada S. Molekylær basis for insulinstimuleret GLUT4-vesikelhandel. Biol Chem. 1999; 274 (5): 2593-2596.
- Schulingkamp RJ, Pagano TC, Hung D, Raffa RB. Insulinreceptorer og insulinhandling i hjernen: gennemgang og kliniske implikationer. Neurovidenskab og bioadfærdsmæssige anmeldelser. 2000; 855-872.
- Wood IS, Trayhurn P. Glucose transporter (GLUT og SGLT): udvidede familier af sukker transportproteiner. Br J Nutr. 2003; 89 (1): 3-9. Zhao FQ, Keating AF. Funktionelle egenskaber og genomik af glukostransportører. Curr Genomics. 2007; 8 (2): 113-28.



Endnu ingen kommentarer