
Hydroxyl (OH) struktur, ion og funktionelle grupper

Det hydroxylgruppe (OH) Det er et, der har et iltatom og ligner et vandmolekyle. Det kan findes som en gruppe, en ion eller en gruppe (OH·). I en verden af organisk kemi danner det en binding i det væsentlige med carbonatomet, selvom det også kan gøre det med svovl eller fosfor.
På den anden side deltager det i uorganisk kemi som en hydroxylion (mere specifikt hydroxid eller hydroxylion). Det vil sige, at typen af binding mellem den og metallerne ikke er kovalent, men ionisk eller koordinerende. På grund af dette er det en meget vigtig "karakter", der definerer egenskaber og transformationer af mange forbindelser..

Som det kan ses på billedet ovenfor, er OH-gruppen bundet til en radikal betegnet med bogstavet R (hvis det er alkyl) eller med bogstavet Ar (hvis det er aromatisk). For ikke at skelne mellem de to er det undertiden repræsenteret knyttet til en “bølge”. Afhængigt af hvad der ligger bag denne "bølge", taler vi således om en organisk forbindelse eller en anden..
Hvad bidrager OH-gruppen til det molekyle, som den binder til? Svaret ligger i deres protoner, som kan "snappes op" af stærke baser for at danne salte; de kan også interagere med andre omgivende grupper gennem hydrogenbindinger. Uanset hvor det er, repræsenterer det en potentiel vanddannende region.
Artikelindeks
- 1 Struktur
- 1.1 Brintbroer
- 2 Hydroxylion
- 3 Dehydrering reaktion
- 4 Funktionelle grupper
- 4.1 Alkoholer
- 4.2 Phenoler
- 4.3 Carboxylsyrer
- 5 Referencer
Struktur
Hvad er strukturen i hydroxylgruppen? Vandmolekylet er vinkelret; det vil sige, det ligner en Boomerang. Hvis de "klipper" en af dens ender - eller hvad der er det samme, skal du fjerne en proton - der kan opstå to situationer: radikalen (OH·) eller hydroxylionen (OH-). Begge har dog en molekylær lineær geometri (men ikke elektronisk).
Dette skyldes naturligvis, at de enkle bindinger orienterer to atomer for at forblive justerede, men det samme sker ikke med deres hybridorbitaler (ifølge valensbindingsteorien).
På den anden side, da vandmolekylet er H-O-H, og ved at vide, at det er vinklet, skifter H for R eller Ar R-O-H eller Ar-O-H. Her har den nøjagtige region, der involverer de tre atomer, vinkelmolekylær geometri, men den for de to O-H-atomer er lineær..
Brintbindinger
OH-gruppen tillader molekylerne, der besidder den, at interagere med hinanden gennem hydrogenbindinger. I sig selv er de ikke stærke, men efterhånden som antallet af OH øges i forbindelsens struktur, formeres deres virkninger og afspejles i forbindelsens fysiske egenskaber..
Da disse broer kræver, at deres atomer vender mod hinanden, skal oxygenatomet i en OH-gruppe danne en lige linje med hydrogenet i en anden gruppe..
Dette giver anledning til meget specifikke rumlige arrangementer, såsom dem, der findes i strukturen af DNA-molekylet (mellem nitrogenholdige baser)..
Ligeledes er antallet af OH-grupper i en struktur direkte proportional med vandets affinitet for molekylet eller omvendt. Hvad betyder det? For eksempel gør sukker, selvom det har en hydrofob kulstofstruktur, det store antal OH-grupper det meget opløseligt i vand..
Imidlertid er intermolekylære interaktioner i nogle faste stoffer så stærke, at de "foretrækker" at forblive sammen i stedet for at opløses i et bestemt opløsningsmiddel..
Hydroxylion
Selvom ionen og hydroxylgruppen er meget ens, er deres kemiske egenskaber meget forskellige. Hydroxylionen er en ekstremt stærk base; det vil sige, det accepterer protoner, selv af kræfter, for at blive vand.
Hvorfor? Fordi det er et ufuldstændigt vandmolekyle, negativt ladet og ivrig efter at komplettere med tilføjelsen af en proton.
En typisk reaktion for at forklare basiciteten af denne ion er følgende:
R-OH + OH- => R-O- + HtoELLER
Dette sker, når en basisk opløsning tilsættes til en alkohol. Her er alkoxidionen (RO-) associeres straks med en positiv ion i opløsning; det vil sige Na-kationen+ (Sårskorpe).
Da OH-gruppen ikke behøver at protoneres, er den en ekstremt svag base, men som det kan ses i den kemiske ligning, kan den donere protoner, dog kun med meget stærke baser..
Ligeledes er det værd at nævne den nukleofile karakter af OH-. Hvad betyder det? Da det er en meget lille negativ ion, kan den rejse hurtigt for at angribe positive kerner (ikke atomkerner).
Disse positive kerner er atomer i et molekyle, der lider af en elektronisk mangel på grund af deres elektronegative miljø..
Dehydrering reaktion
OH-gruppen accepterer kun protoner i stærkt sure medier, hvilket fører til følgende reaktion:
R-OH + H+ => R-OtoH+
I dette udtryk H+ er en sur proton doneret af en meget sur art (HtoSW4, HCI, HI osv.). Her dannes et vandmolekyle, men det er knyttet til resten af den organiske (eller uorganiske) struktur.
Den positive delvise ladning på iltatomet forårsager svækkelse af R-O-bindingentoH+, hvilket resulterer i frigivelse af vand. Af denne grund er det kendt som en dehydratiseringsreaktion, da alkoholer i sure medier frigiver flydende vand..
Hvad kommer dernæst? Dannelsen af såkaldte alkener (RtoC = CRto eller RtoC = CHto).
Funktionelle grupper
Alkoholer
Hydroxylgruppen er i sig selv allerede en funktionel gruppe: alkoholerne. Eksempler på denne type forbindelse er ethylalkohol (EtOH) og propanol (CH3CHtoCHtoOH).
De er generelt blandbare væsker med vand, fordi de kan danne hydrogenbindinger mellem deres molekyler.
Phenoler
En anden type alkoholer er aromater (ArOH). Ar betegner en arylgruppe, som ikke er mere end en benzenring med eller uden alkylsubstituenter.
Aromaliteten af disse alkoholer gør dem resistente over for syre protonangreb; de kan med andre ord ikke være dehydreret (så længe OH-gruppen er direkte knyttet til ringen).
Dette er tilfældet med phenol (C6H5OH):
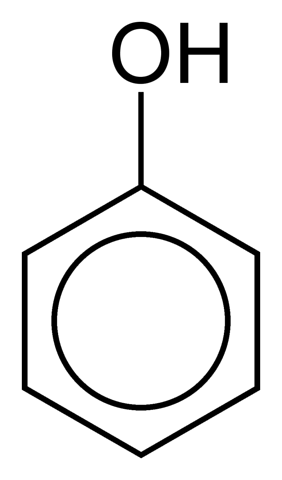
Den phenoliske ring kan være en del af en større struktur, som i aminosyren tyrosin.
Carboxylsyrer
Endelig udgør hydroxylgruppen syrekarakteren af carboxylgruppen til stede i organiske syrer (-COOH). Her er OH, i modsætning til alkoholer eller phenoler, meget sur, dens proton doneres til stærke eller let stærke baser..
Referencer
- Helmenstine, Anne Marie, Ph.D. (7. februar 2017). Definition af Hydroxyl Group. Hentet fra: thoughtco.com
- Wikipedia. (2018). Hydroxy-gruppe. Hentet fra: en.wikipedia.org
- Biologiprojektet. (25. august 2003). Hydroxylaminosyrer. Institut for Biokemi og Molekylær Biofysik University of Arizona. Hentet fra: biology.arizona.edu
- Dr. J.A. Colapret. Alkoholer. Hentet fra: colapret.cm.utexas.edu
- Quimicas.net (2018). Hydroxyl-gruppen. Gendannet fra: quimicas.net
- Dr. Ian Hunt. Dehydrering af alkoholer. Institut for Kemi, University of Calgary. Hentet fra: chem.ucalgary.ca



Endnu ingen kommentarer