
Lithiumhydridstruktur, egenskaber, produktion, anvendelser

Det lithiumhydrid det er et krystallinsk uorganisk fast stof, hvis kemiske formel er LiH. Det er det letteste uorganiske salt, dets molekylvægt er kun 8 g / mol. Det er dannet af foreningen af en lithiumion Li+ og en hydridion H-. Begge er forbundet med en ionbinding.
LiH har et højt smeltepunkt. Det reagerer let med vand, og der dannes brintgas i reaktionen. Det kan opnås ved reaktionen mellem smeltet lithiummetal og hydrogengas. Det er meget brugt i kemiske reaktioner for at opnå andre hydrider.
LiH er blevet brugt til at beskytte mod farlig stråling såsom dem, der findes i atomreaktorer, det vil sige ALPHA, BETA, GAMMA-stråling, protoner, røntgenstråler og neutroner..
Det er også blevet foreslået til beskyttelse af materialer i rumraketter drevet af kernevarmedrivning. Undersøgelser udføres endda for at blive brugt som beskyttelse af mennesket mod kosmisk stråling under fremtidige ture til planeten Mars..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Selvantændelsestemperatur
- 3.6 Tæthed
- 3.7 Opløselighed
- 3.8 Andre egenskaber
- 4 Opnåelse
- 5 Anvendes som et beskyttende skjold mod farlig stråling
- 5.1 - I atomreaktorer
- 5.2 - I rumsystemer med nuklear termisk fremdrift
- 5.3 - Til beskyttelse mod kosmisk stråling
- 6 Anvendes som et middel til sikker opbevaring og transport af brint
- 7 Anvendelse i kemiske reaktioner
- 8 Referencer
Struktur
Hydrogen i lithiumhydrid har en negativ ladning H-, da den har trukket en elektron fra metallet, som er i form af en Li-ion+.
Li-kationens elektronkonfiguration+ er: [Han] 1sto hvilket er meget stabilt. Og den elektroniske struktur af hydridanionen H- er: 1sto, hvilket også er meget stabilt.
Kationen og anionen er forbundet med elektrostatiske kræfter.
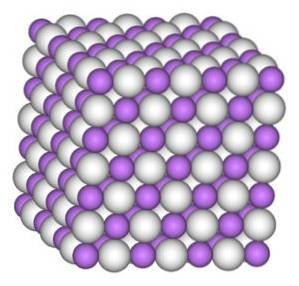
Lithiumhydridkrystallen har den samme struktur som natriumchlorid NaCl, det vil sige en kubisk krystalstruktur.
Nomenklatur
- Lithiumhydrid
- LiH
Ejendomme
Fysisk tilstand
Hvidt eller farveløst krystallinsk fast stof. Kommerciel LiH kan være blågrå på grund af tilstedeværelsen af små mængder lithiummetal..
Molekylær vægt
8 g / mol
Smeltepunkt
688 ºC
Kogepunkt
Det nedbrydes ved 850 ºC.
Selvantændelsestemperatur
200 ºC
Massefylde
0,78 g / cm3
Opløselighed
Reagerer med vand. Det er uopløseligt i ethere og kulbrinter.
Andre egenskaber
Lithiumhydrid er meget mere stabil end hydrider fra de andre alkalimetaller og kan smeltes uden nedbrydning..
Det påvirkes ikke af ilt, hvis det opvarmes til temperaturer under rødt. Det er også upåvirket af chlor Clto og saltsyre HCI.
LiH's kontakt med varme og fugtighed forårsager en eksoterm reaktion (genererer varme) og udvikling af hydrogen Hto og lithiumhydroxid LiOH.
Det kan danne et fint støv, der kan eksplodere i kontakt med flammer, varme eller oxiderende materialer. Det må ikke komme i kontakt med dinitrogenoxid eller flydende ilt, da det kan eksplodere eller antænde.
Det mørkner, når det udsættes for lys.
Opnåelse
Lithiumhydrid er opnået i laboratoriet ved reaktion mellem smeltet lithiummetal og hydrogengas ved en temperatur på 973 K (700 ºC).
2 Li + Hto → 2 LiH
Gode resultater opnås, når den eksponerede overflade af det smeltede lithium øges, og når sedimentationstiden for LiH nedsættes. Det er en eksoterm reaktion.
Anvendes som et beskyttende skjold mod farlig stråling
LiH har en række egenskaber, der gør det attraktivt til brug som beskyttelse for mennesker i atomreaktorer og rumsystemer. Her er nogle af disse egenskaber:
- Det har et højt indhold af brint (12,68 vægt% H) og et stort antal brintatomer pr. Volumenhed (5,85 x 1022 H-atomer / cm3).
- Dets høje smeltepunkt gør det muligt at bruge det i omgivelser med høj temperatur uden at smelte.
- Det har et lavt dissociationstryk (~ 20 torr ved dets smeltepunkt), som gør det muligt at smelte og fryse materialet uden at nedbrydes under lavt hydrogentryk..
- Det har en lav densitet, hvilket gør det attraktivt til brug i rumsystemer..
- Imidlertid er dens ulemper dens lave varmeledningsevne og dårlige mekaniske egenskaber. Men dette har ikke mindsket dets anvendelighed.
- LiH-delene, der fungerer som skjolde, fremstilles ved varm- eller koldpresning og ved smeltning og hældning i forme. Selvom denne sidste form foretrækkes.
- Ved stuetemperatur er delene beskyttet mod vand og vanddamp og ved høje temperaturer ved et lille overtryk af brint i en forseglet beholder.
- I atomreaktorer
I atomreaktorer er der to typer stråling:
Direkte ioniserende stråling
De er meget energiske partikler, der bærer elektrisk ladning, såsom alfa (α) og beta (β) partikler og protoner. Denne type stråling interagerer meget stærkt med skjoldmaterialerne og forårsager ionisering ved at interagere med elektronerne i atomer i materialerne, gennem hvilke de passerer..
Indirekte ioniserende stråling
De er neutroner, gammastråler (γ) og røntgenstråler, som trænger ind og kræver massiv beskyttelse, da de involverer emission af sekundære ladede partikler, som er dem, der forårsager ionisering..

Ifølge nogle kilder er LiH effektiv til at beskytte materialer og mennesker mod disse typer af stråling.
- I rumsystemer med nuklear termisk fremdrift
LiH er for nylig blevet valgt som en potentiel moderator og nuklear strålingsafskærmende materiale til meget lange sejladsfartøjer med kernekraftværker..

Dens lave densitet og høje brintindhold gør det muligt at reducere massen og volumenet af den atomdrevne reaktor effektivt..
- I beskyttelse mod kosmisk stråling
Eksponering for rumstråling er den vigtigste risiko for menneskers sundhed i fremtidige interplanetariske efterforskningsmissioner.
I det dybe rum vil astronauter blive udsat for hele spektret af galaktiske kosmiske stråler (ioner med høj energi) og hændelser fra solpartikler (protoner)..
Faren for strålingseksponering forstærkes af missionernes længde. Derudover skal beskyttelsen af de steder, som opdagelsesrejsende bebor, også overvejes.

I denne retning viste en undersøgelse, der blev udført i 2018, at LiH blandt de testede materialer giver den største reduktion i stråling pr. Gram pr. Cmto, således at være en af de bedste kandidater, der skal bruges til beskyttelse mod kosmisk stråling. Disse undersøgelser skal dog uddybes.
Anvendes som et sikkert opbevarings- og transportmedium til brint
At få energi fra Hto Det er noget, der er blevet undersøgt i flere dusin år og allerede har fundet anvendelse til at erstatte fossile brændstoffer i transportkøretøjer.
Hto kan bruges i brændselsceller og bidrage til at reducere CO-produktionento og nejx, og dermed undgå drivhuseffekten og forurening. Imidlertid er der endnu ikke fundet et effektivt system til opbevaring og transport af Hto sikkert, let, kompakt eller lille i størrelse, hurtig at opbevare og frigøre Hto lige så hurtigt.
Lithiumhydrid LiH er et af de alkalihydrider, der har den højeste lagringskapacitet for Hto (12,7 vægt-% H). Slip Hto ved hydrolyse ifølge følgende reaktion:
LiH + HtoO → LiOH + Hto
LiH leverer 0,254 kg brint til hvert kg LiH. Derudover har den en høj lagerkapacitet pr. Volumenhed, hvilket betyder, at den er let og er et kompakt medium til opbevaring af Hto.

Derudover dannes LiH lettere end andre alkalimetalhydrider og er kemisk stabil ved omgivelsestemperaturer og tryk. LiH kan transporteres fra producenten eller leverandøren til brugeren. Derefter genereres H ved hydrolyse af LiHto og dette bruges sikkert.
Det dannede lithiumhydroxid LiOH kan returneres til leverandøren, der regenererer lithium ved elektrolyse og derefter producerer LiH igen..
LiH er også blevet undersøgt med succes til anvendelse i forbindelse med boreret hydrazin til samme formål..
Anvendelse i kemiske reaktioner
LiH tillader syntese af komplekse hydrider.
Det bruges for eksempel til fremstilling af lithiumtriethylborhydrid, som er en stærk nukleofil i organiske halogenid-fortrængningsreaktioner..
Referencer
- Sato, Y. og Takeda, O. (2013). Hydrogenopbevarings- og transportsystem gennem lithiumhydrid ved hjælp af smeltet saltteknologi. I kemi med smeltet salte. Kapitel 22, sider 451-470. Gendannet fra sciencedirect.com.
- OS. National Library of Medicine. (2019). Lithiumhydrid. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- Wang, L. et al. (2019). Undersøgelse af indvirkningen af den termiske kerneeffekt af lithiumhydrid på reaktiviteten af atomfremdrivning partikellejereaktor. Annaler om nuklear energi 128 (2019) 24-32. Gendannet fra sciencedirect.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Giraudo, M. et al. (2018). Acceleratorbaserede tests med afskærmningseffektivitet af forskellige materialer og flerlag ved hjælp af højenergi lette og tunge ioner. Strålingsforskning 190; 526-537 (2018). Gendannet fra ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Lithiumhydrid: Et rumalderafskærmende materiale. Nuclear Engineering and Design 26, 3, februar 1974, side 444-460. Gendannet fra sciencedirect.com.
- Simnad, M.T. (2001). Atomreaktorer: Afskærmningsmaterialer. I Encyclopedia of Materials: Science and Technology (Anden udgave). Sider 6377-6384. Gendannet fra sciencedirect.com.
- Hügle, T. et al. (2009). Hydrazin Borane: Et lovende materiale til lagring af brint. J. Am. Chem. Soc. 2009, 131, 7444-7446. Gendannet fra pubs.acs.org.



Endnu ingen kommentarer