
Fosforoxid (v) struktur, egenskaber, opnåelse, anvendelser, risici

Det fosforoxid (v) Det er et uorganisk fast stof dannet af fosfor (P) og ilt (O). Dens empiriske formel er PtoELLER5, mens dens korrekte molekylformel er P4ELLER10. Det er et meget hygroskopisk hvidt fast stof, det vil sige, det kan absorbere vand fra luften meget let og reagere straks med det. Reaktionen kan være farlig, da den forårsager en hurtig stigning i temperaturen.
Dens høje tendens til at absorbere vand har fået det til at blive brugt som et tørremiddel i kemiske laboratorier såvel som en dehydrator af nogle forbindelser, det vil sige at fjerne vand fra dets molekyler..

Fosforoxid (v) bruges også til at fremskynde bindingsreaktionerne i forskellige carbonhydridmolekyler, en reaktion kaldet kondensation. Derudover tillader det at omdanne visse organiske syrer til estere.
Det er f.eks. Blevet brugt til at raffinere benzin til fremstilling af phosphorsyre H3PO4, at opnå forbindelser, der tjener til at forsinke ild, at fremstille glas til vakuumapplikationer, blandt mange andre anvendelser.
Fosforoxid (v) skal opbevares i tæt lukkede beholdere for at forhindre, at det kommer i kontakt med fugt i luften. Det er ætsende og kan beskadige øjne, hud og slimhinder..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Sublimeringstemperatur
- 3.5 Densitet
- 3.6 Opløselighed
- 3.7 Kemiske egenskaber
- 3.8 Andre egenskaber
- 4 Opnåelse
- 4.1 Tilstedeværelse i naturen
- 5 anvendelser
- 5.1 Som et dehydratiserings- og tørringsmiddel
- 5.2 I organiske kemiske reaktioner
- 5.3 I brændstofraffinering
- 5.4 I forskellige applikationer
- 6 risici
- 7 Referencer
Struktur
Fosforoxid (v) består af fosfor (P) og ilt (O), hvor fosfor har en valens på +5 og ilt -2. Fosforoxidmolekylet (v) har fire fosfor- og ti iltatomer, og det er derfor, at dets korrekte molekylformel er P4ELLER10.
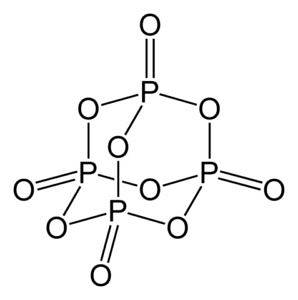
Den findes i tre krystallinske former, som amorft pulver og i glaslegemisk form (som glas). I den sekskantede krystallinske form findes hvert af de phosphoratomer ved hjørnerne af en tetraeder..
Nomenklatur
- Fosforoxid (v)
- Phosphorpentoxid
- Diphosphorpentoxid
- Fosforpentoxid
- Fosforsyreanhydrid
- Tetrafosfor decaoxid
Ejendomme
Fysisk tilstand
Krystallinsk hvidt fast stof. Den mest almindelige form er sekskantede krystaller.
Molekylær vægt
283,89 g / mol
Smeltepunkt
562 ºC
Sublimeringstemperatur
360 ºC ved 1 atmosfæres tryk. Det betyder, at det ved denne temperatur går fra fast til gas uden at gå gennem flydende tilstand.
Massefylde
2,30 g / cm3
Opløselighed
Meget opløseligt i vand. Opløselig i svovlsyre. Uopløselig i acetone og ammoniak.
Kemiske egenskaber
Fosforoxid (v) absorberer og reagerer ekstremt hurtigt med vand i luften og danner fosforsyre H3PO4. Denne reaktion er eksoterm, hvilket betyder, at der produceres varme under reaktionen..
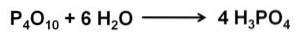
Reaktionen af P4ELLER10 med vand fører til dannelsen af en blanding af fosforsyrer, hvis sammensætning afhænger af mængden af vand og forholdene.
Reaktionen med alkoholer fører til dannelsen af estere af phosphorsyre eller af polymere syrer afhængigt af de eksperimentelle betingelser..
P4ELLER10 + 6 ROH → 2 (RO)toPO.OH + 2 RO.PO (OH)to
Med basiske oxider danner det faste fosfater.
Det er ætsende. Kan reagere farligt med myresyre og uorganiske baser såsom natriumhydroxid (NaOH), calciumoxid (CaO) eller natriumcarbonat NatoCO3.
Hvis du hælder en opløsning af perchlorsyre HCI4 og chloroform CHCl3 i phosphoroxid (v) P4ELLER10 der opstår en voldsom eksplosion.
Andre egenskaber
Det er ikke brandfarligt. Det fremmer ikke forbrænding. Imidlertid er dets reaktion med vand så voldsom og eksoterm, at der kan være risiko for brand..
Opnåelse
Det kan fremstilles ved direkte oxidation af fosfor i en strøm af tør luft. Fosfor når det kommer i kontakt med overskydende ilt oxiderer og danner fosforoxid (v).
P4 + 5 Oto → S4ELLER10
Tilstedeværelse i naturen
Fosfor (v) oxid findes i mineraler som ilmenit, rutil og zircon.
Ilmenit er et mineral, der indeholder jern og titanium og undertiden har fosfor (v) oxid i koncentrationer, der varierer mellem 0,04 og 0,33 vægt%. Rutil er et mineral af titaniumoxid og kan indeholde ca. 0,02 vægt-% PtoELLER5.
Zirkonsand (et mineral af elementet zirconium) har fosforoxid (v) i 0,05-0,39 vægtprocent.
Ansøgninger
Som et dehydratiserings- og tørringsmiddel
På grund af sin store vandgrådighed er det et af de mest kendte dehydratiserende stoffer og meget effektivt ved temperaturer under 100 ° C..
Det kan ekstrahere vand fra stoffer, der selv betragtes som dehydratiserende stoffer. For eksempel kan du fjerne vand fra svovlsyre HtoSW4 gør det til SO3 og salpetersyre HNO3 gør det til NtoELLER5.

Dybest set kan den tørre alle de væsker og gasser, som den ikke reagerer med, så det gør det muligt at fjerne spor af fugt fra vakuumsystemer.
I organisk kemi reaktioner
Fosforoxid (v) tjener til at lukke ringe af organiske forbindelser og andre kondensationsreaktioner.
Det gør det muligt at esterificere organiske syrer med mulighed for at skelne mellem primære alifatiske carboxylsyrer (carbonkæde uden ringe med -COOH-gruppen i den ene ende) og aromatiske syrer (-COOH-gruppe bundet til benzenringen), da sidstnævnte ikke reagerer.
Det tjener også til at fjerne et molekyle af HtoO af amiderne R (C = O) NHto og omdanner dem til R-CN-nitriler. Derudover katalyserer eller fremskynder det iltning, dehydrogenering og polymerisationsreaktioner af bitumen.

I brændstofraffinering
Siden 30'erne af det 20. århundrede viste visse undersøgelser, at fosfor (v) oxid udøvede en raffineringsvirkning på benzin, hvilket øgede dets oktantal.
P's raffineringshandling4ELLER10 det skyldes hovedsageligt kondensationsreaktioner (forening af forskellige molekyler) og ikke polymerisering (forening af lige molekyler).
Siden4ELLER10 fremskynder den direkte alkylering af aromatiske carbonhydrider med olefiner, omdannelsen af olefiner til naphthener og deres delvise polymerisation. Alkyleringsreaktionen øger oktantallet af benzin.
På denne måde opnås en raffineret benzin af høj kvalitet.

I forskellige applikationer
Fosforoxid (v) bruges til at:
- Forbered phosphorsyre H3PO4
- Få akrylatestere og overfladeaktive stoffer
- Forbered fosfatestere, der bruges som flammehæmmere, opløsningsmidler og fortyndingsmidler
- Omdannelse af phosphortrichlorid til phosphoroxichlorid
- Laboratoriereagens
- Fremstil specielt glas til vakuumrør
- Forøg asfaltets smeltepunkt
- Serveres som et standardmolekyle til bestemmelse af fosfor eller fosfater i fosfatsten, gødning og Portlandcement i form af PtoELLER5
- Forbedre bindingerne mellem visse polymerer og det elfenbenlag, som tænderne har

Risici
Fosfor (v) oxid skal opbevares i forseglede beholdere og på et køligt, tørt, godt ventileret sted.
Dette tjener til at forhindre det i at komme i kontakt med vand, da det kan reagere voldsomt med det og generere en masse varme til det punkt, at det brænder nærliggende materialer, der er brændbare..
Fosfor (v) oxidstøv er irriterende for øjnene og luftvejene og ætsende for huden. Kan forårsage øjenforbrændinger. Indtagelse medfører livsfarlige indre forbrændinger.
Referencer
- OS. National Library of Medicine. (2019). Fosforsyreanhydrid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Nayler, P. (2001). Bitumen: Modificeret. Kemisk modifikation. I Encyclopedia of Materials: Science and Technology. Gendannet fra sciencedirect.com.
- Malishev, B.W. (1936). Fosforpentoxid som raffineringsmiddel til benzin. Industriel og ingeniørkemi 1936, 28, 2, 190-193. Gendannet fra pubs.acs.org.
- Epps, Jr. E.A. (1950). Fotometrisk bestemmelse af tilgængeligt phosphorpentoxid i gødning. Analytisk kemi 1950, 22, 8, 1062-1063. Gendannet fra pubs.acs.org.
- Banerjee, A. et al. (1983). Anvendelse af fosforpentoxid: esterificering af organiske syrer. J. Org. Chem. 1983, 48, 3108-3109. Gendannet fra pubs.acs.org.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde udgave. John Wiley & Sons.
- Ogliari, F.A. et al. (2008). Syntese af phosphatmonomerer og binding til dentin: esterificeringsmetoder og anvendelse af phosphorpentoxid. Journal of Dentistry, bind 36, udgave 3, marts 2008, side 171-177. Gendannet fra sciencedirect.com.



Endnu ingen kommentarer