
Incretintyper og deres struktur, funktioner, virkningsmekanisme
Det inkretin er gastrointestinale hormoner, der stimulerer udskillelsen af fysiologiske koncentrationer af insulin. Udtrykket bruges i øjeblikket til at henvise til to forskellige tarmhormoner, som har forskellige tekniske navne: GIP eller "glukoseafhængigt insulinotropisk polypeptid" og GLP-1 eller "glukagon-lignende peptid 1".
"Incretin" er et ord og et koncept, der blev opfundet i 1932 af den belgiske fysiolog Jean La Barre, der introducerede det til at definere de intestinale hormonelle faktorer, der supplerede virkningen af secretin på endokrin bugspytkirtelsekretion..
Med andre ord brugte La Barre udtrykket incretin til at betegne ethvert tarmhormon, der under fysiologiske forhold var i stand til at stimulere eller bidrage til udskillelsen af bugspytkirtelhormoner såsom insulin, glukagon, bugspytkirtelpolypeptid (PP) og somatostatin..
Imidlertid anvendes i øjeblikket udtrykket "incretin" kun til at betegne de hormoner, der er i stand til at stimulere glucose-afhængig pancreasinsulinsyntese, specifikt to peptider kendt som GIP og GLP-1. Imidlertid kunne fremkomsten af ny teknologi og dybere endokrinologiske undersøgelser afsløre mange andre peptider med lignende aktiviteter..
Artikelindeks
- 1 Typer af inkretiner og deres struktur
- 2 funktioner
- 3 Handlingsmekanisme
- 3.1 GIP: Glukoseafhængig insulinotropisk polypeptid
- 3.2 GLP-1: Glukagonlignende peptid 1
- 4 Referencer
Typer af inkretiner og deres struktur
Traditionelt er kun to inkretiner blevet defineret hos mennesker: glukoseafhængig insulinotropisk polypeptid (GIP) og glukagon-lignende peptid 1 (GLP-1); de to hormoner virker yderligere ved at stimulere insulinsekretion.
Den første af disse, der blev isoleret, var glukoseafhængig insulinotropisk polypeptid (GIP). Glukoseafhængigt insulinotropisk polypeptid). Det er et peptidhormon med ca. 42 aminosyrer og hører til peptidernes glucagon-secretinfamilie.

Det andet opdagede incretin var glucagon-lignende peptid 1 (GLP-1). Glukagonlignende peptid-1), som er et biprodukt af genet, der koder for hormonet "proglucagon"; del af den C-terminale ende af proteinet for at være mere præcis.
Funktioner
Oprindeligt blev inkretiner defineret som faktorer afledt fra tarmkanalen, der har evnen til at sænke plasmaglucoseniveauer gennem stimulering af sekretionen af bugspytkirtelhormoner såsom insulin og glukagon..
Dette koncept blev opretholdt med fremkomsten af radioimmunoanalyser, hvor permanent kommunikation mellem tarmen og den endokrine bugspytkirtel blev bekræftet..
Oral glukoseadministration blev vist at være forbundet med signifikante stigninger i plasmainsulinniveauer, især sammenlignet med resultater opnået med intravenøs glukose..
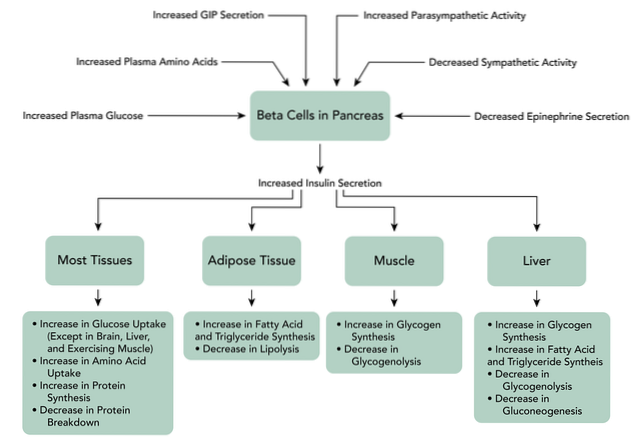
Incretiner menes at være ansvarlige for sekretionen af næsten 70% af plasmainsulin efter oral glukoseindgivelse, da de er hormoner, der udskilles som reaktion på indtag af næringsstoffer, hvilket forbedrer udskillelsen af glucoseinsulin..
Der gøres i øjeblikket mange bestræbelser vedrørende oral eller intravenøs administration af incretiner til patienter med sygdomme såsom type 2-diabetes mellitus eller oral glukoseintolerance. Dette skyldes, at undersøgelser har vist, omend foreløbigt, at disse stoffer letter det hurtige fald i glykæmisk niveau efter fødeindtagelse..
Handlingsmekanisme
GIP: Glukoseafhængig insulinotropisk polypeptid
Dette incretin produceres af K-cellerne i tyndtarmen (i tolvfingertarmen og jejunum specifikt) som reaktion på indtagelse af fedt eller glukose og er ansvarlig for at øge glukosestimuleret insulinsekretion.
Ekspressionen af genet, der koder for denne hormonelle faktor, er blevet demonstreret hos mennesker og gnavere både i maven og i tarmen. Undersøgelser udført med dette hormon indikerer, at det stammer fra en 153 aminosyre "proGIP" -forløber, som har to signalpeptider ved sine N- og C-terminale ender, som spaltes for at give et aktivt peptid med 42 rester..
Halveringstiden for GIP er mindre end 7 minutter, når den først er syntetiseret og behandlet enzymatisk. Dette peptid genkendes af en specifik receptor, GIPR, som er placeret i plasmamembranen i cellerne i bugspytkirtlen, i maven, i tyndtarmen, i fedtvæv, i binyrebarken, i hypofysen, i hjerte, lunger og andre større organer.
Når GIP binder til sine receptorer på betacellerne i bugspytkirtlen, udløser det en stigning i produktionen af cAMP, også inhibering af ATP-afhængige kaliumkanaler, stigningen i intracellulært calcium og endelig eksocytosen af insulinopbevaringsgranulerne..
Derudover kan dette peptid stimulere gentranskription og insulinbiosyntese såvel som de andre komponenter i betaceller i bugspytkirtlen til "optælling" af glucose. Selvom GIP hovedsageligt fungerer som et incretinhormon, udøver det også andre funktioner i andre væv såsom centralnervesystemet, blandt andet knogler..
GLP-1: Glukagonlignende peptid 1
Dette peptid er produceret af genet, der koder for "proglucagon", så det er et peptid, der deler tæt på 50% identitet med glucagon-sekvensen og kaldes derfor "glucagon-lignende" peptid.
GLP-1, et post-translationelt proteolytisk produkt, er vævsspecifikt og produceres af tarmens L-celler som reaktion på fødeindtagelse. Ligesom GIP har dette incretin evnen til at øge glukosestimuleret insulinsekretion.
Genekspression og behandling
Dette peptid er kodet i et af proglucagon-genets eksoner, som udtrykkes i alfa-cellerne i bugspytkirtlen, i tarmens L-celler (i det distale ileum) og i neuroner i hjernestammen og hypothalamus.
I bugspytkirtlen stimuleres ekspressionen af dette gen ved faste og hypoglykæmi (lave koncentrationer af glukose i blodet) og hæmmes af insulin. I tarmceller aktiveres ekspressionen af genet for proglucagon ved øgede niveauer af cAMP og fødeindtag.
Produktet, der er resultatet af ekspressionen af dette gen, behandles post-translationelt i de enteroendokrine L-celler (i tyndtarmen), hvilket ikke kun resulterer i frigivelse af glukagon-lignende peptid 1, men også i andre noget ukendte faktorer såsom glicentin, oxyintomodulin, glucagon-lignende peptid 2 osv..
Produktion og handling
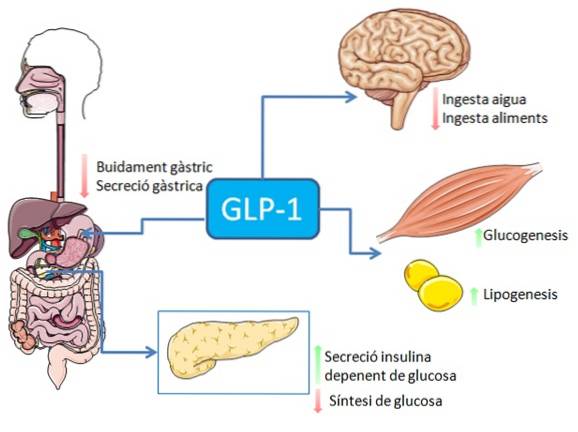
Indtagelse af fødevarer, især de, der er rige på fedt og kulhydrater, stimulerer udskillelsen af GLP-1-peptidet fra intestinale enteroendokrine L-celler (nervestimulering eller stimulering medieret af mange andre faktorer kan også forekomme).
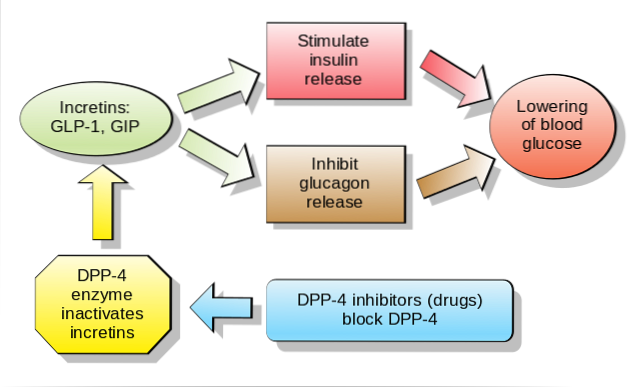
Hos mennesker og gnavere frigives dette peptid i blodbanen i to faser: 10-15 minutter efter indtagelse og 30-60 minutter senere. Den aktive levetid for dette hormon i blodet er mindre end 2 minutter, da det hurtigt inaktiveres proteolytisk af enzymet dipeptidylpeptidase-4 (DPP-4).
GLP-1 binder til en specifik membranreceptor (GLP-1R) på forskellige celler i kroppen, herunder nogle af de endokrine celler i bugspytkirtlen, hvor det stimulerer glukoseafhængig insulinsekretion.
Hvordan?
Binding af GLP-1 til dets receptor på betaceller i bugspytkirtlen aktiverer produktionen af cAMP medieret af adenylatcyclase i disse celler. Der er en direkte inhibering af ATP-afhængige kaliumkanaler, som depolariserer cellemembranen.
Derefter øges intracellulært calciumniveau, hvilket er resultatet af GLP-1-afhængig tilstrømning af ekstracellulært calcium gennem spændingsafhængige calciumkanaler, aktivering af ikke-selektive kationkanaler og mobilisering af calciumreserver..
Det øger også mitokondrie ATP-syntese, hvilket favoriserer depolarisering. Senere lukkes de spændingsstyrede kaliumkanaler, hvilket forhindrer repolarisering af beta-cellerne, og endelig forekommer eksocytose af insulinlagringsgranulerne..
I det gastrointestinale system har binding af GLP-1 til dets receptorer en hæmmende virkning på gastrisk syresekretion og gastrisk tømning, hvilket dæmper stigningen i blodsukkerniveauet forbundet med fødeindtagelse..
Referencer
- Baggio, L. L. og Drucker, D. J. (2007). Biologi af incretiner: GLP-1 og GIP. Gastroenterologi, 132 (6), 2131-2157.
- Deacon, C. F., og Ahrén, B. (2011). Inkretins fysiologi i sundhed og sygdom. Gennemgang af diabetiske studier: RDS, 8 (3), 293.
- Grossman, S. (2009). Differentiering af Incretin-terapier baseret på strukturaktivitet og metabolisme: Fokus på liraglutid. Farmakoterapi: Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., & Egan, J. M. (2008). Incretins rolle i glukosehomeostase og diabetesbehandling. Farmakologiske anmeldelser, 60 (4), 470-512.
- Nauck, M. A., & Meier, J. J. (2018). Incretinhormoner: deres rolle i sundhed og sygdom. Diabetes, fedme og stofskifte, 20, 5-21.
- Rehfeld, J. F. (2018). Oprindelsen og forståelsen af inkretinkonceptet. Grænser inden for endokrinologi, 9.
- Vilsbøll, T., & Holst, J. J. (2004). Incretiner, insulinsekretion og type 2-diabetes mellitus. Diabetologia, 47 (3), 357-366


Endnu ingen kommentarer