
Immunoglobulins struktur, typer og funktioner
Det immunoglobuliner De er molekyler, der fremstiller B-lymfocytter og plasmaceller, der samarbejder med kroppens forsvar. De består af et glykoproteinbiomolekyle, der hører til immunsystemet. De er et af de mest rigelige proteiner i blodserum efter albumin.
Antistof er et andet navn for immunglobuliner, og de betragtes som globuliner på grund af deres opførsel i elektroforese af blodserumet, der indeholder dem. Immunglobulinmolekylet kan være simpelt eller komplekst, afhængigt af om dets præsentation er som en monomer, eller om den er polymeriseret..

Den almindelige struktur af immunglobuliner svarer til bogstavet "Y". Der er fem typer immunglobuliner, der præsenterer morfologiske, funktionelle og placeringsforskelle i kroppen. De strukturelle forskelle i antistoffer er ikke i form, men i sammensætning; hver type har et specifikt mål.
Immunresponset fremmet af immunglobuliner er meget specifikt og er en meget kompleks mekanisme. Stimuleringen for dets udskillelse af celler aktiveres i nærvær af fremmede stoffer i kroppen, såsom bakterier. Immunglobulinets funktion vil være at binde til det fremmede element og eliminere det.
Immunoglobuliner eller antistoffer kan være til stede både i blodet og på organernes membranoverflade. Disse biomolekyler repræsenterer vigtige elementer i det menneskelige legems forsvarssystem..
Artikelindeks
- 1 Struktur
- 1.1 Tunge kæder
- 1.2 Lette kæder
- 1.3 Segmenter Fc og Fab
- 2 slags
- 2.1 Immunglobulin G (IgG)
- 2.2 Immunglobulin M (IgM)
- 2.3 Immunoglobulin A (IgA)
- 2.4 Immunglobulin E (IgE)
- 2,5 Immunoglobulin D (IgD)
- 2.6 Typeændring
- 3 funktioner
- 3.1 Generelle funktioner
- 3.2 Specifikke funktioner
- 4 Referencer
Struktur
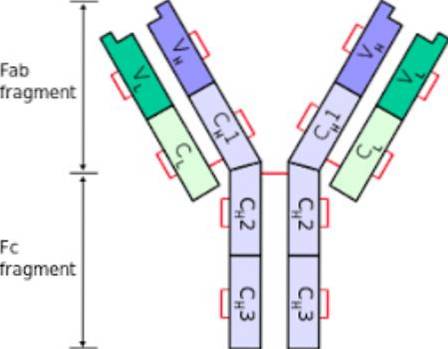
Antistoffernes struktur indeholder aminosyrer og kulhydrater, oligosacchariderne. Den dominerende tilstedeværelse af aminosyrer, deres mængde og fordeling er det, der bestemmer immunglobulinets struktur..
Som alle proteiner har immunglobuliner primære, sekundære, tertiære og kvaternære strukturer, der bestemmer deres typiske udseende..
Med hensyn til antallet af aminosyrer, de præsenterer, har immunglobuliner to typer kæde: tung kæde og let kæde. Derudover har hver af kæderne ifølge aminosyresekvensen i dens struktur en variabel region og en konstant region..
Tunge kæder
De tunge kæder af immunglobuliner svarer til polypeptidenheder, der består af sekvenser på 440 aminosyrer..
Hvert immunglobulin har 2 tunge kæder, og hver af disse har igen en variabel region og en konstant region. Den konstante region har 330 aminosyrer og de variable 110 aminosyrer sekventeret.
Strukturen i den tunge kæde er forskellig for hvert immunglobulin. Der er i alt 5 typer tunge kæder, der bestemmer typerne af immunglobulin.
Tyve kædetyper identificeres med de græske bogstaver γ, μ, α, ε, δ for henholdsvis immunglobuliner IgG, IgM, IgA, IgE og IgD..
Den konstante region af de tunge kæder ε og μ dannes af fire domæner, mens de svarende til α, γ, δ har tre. Derefter vil hver konstant region være forskellig for hver type immunglobulin, men fælles for immunglobuliner af samme type..
Den variable kæde med tung kæde består af et enkelt immunglobulindomæne. Denne region har en sekvens på 110 aminosyrer og vil være forskellig afhængig af specificiteten af antistoffet for et antigen..
I strukturen af tunge kæder kan der observeres en vinkling eller bøjning - kaldet et hængsel - som repræsenterer det fleksible område af kæden.
Let kæder
Immunoglobulin lette kæder er polypeptider, der består af ca. 220 aminosyrer. Der er to typer let kæde hos mennesker: kappa (κ) og lambda (λ), sidstnævnte med fire undertyper. De konstante og variable domæner har sekvenser på hver 110 aminosyrer..
Et antistof kan have to κ (κκ) lette kæder eller et par λ (λλ) kæder, men det er ikke muligt for det at have en af hver type på samme tid.
Segmenter Fc og Fab
Da hvert immunglobulin er formet som et "Y", kan det opdeles i to segmenter. Det "nedre" segment, basen, kaldes den krystalliserbare fraktion eller Fc; mens armene på "Y" danner Fab eller den fraktion, der binder til antigenet. Hver af disse strukturelle sektioner af immunglobulin udfører en anden funktion..
Segment Fc
Fc-segmentet har to eller tre konstante domæner af tunge immunglobulin-kæder.
Fc kan binde til proteiner eller en specifik receptor på basofiler, eosinofiler eller mastceller og derved inducere det specifikke immunrespons, der vil eliminere antigenet. Fc svarer til carboxylterminalen af immunglobulin.
Fantastisk segment
Fab-fraktionen eller segmentet af et antistof indeholder de variable domæner i dens ender ud over de konstante domæner i de tunge og lette kæder.
Det tunge kædes konstante domæne fortsættes med domænerne i Fc-segmentet, der danner hængslet. Svarer til den aminoterminale ende af immunoglobulin.
Vigtigheden af Fab-segmentet er, at det tillader binding med antigener, fremmede og potentielt skadelige stoffer.
De variable domæner af hvert immunglobulin garanterer dets specificitet for et givet antigen; denne egenskab tillader endda dens anvendelse til diagnose af inflammatoriske og infektiøse sygdomme.
Typer

De hidtil kendte immunglobuliner har en specifik tung kæde, der er konstant for hver af disse og adskiller sig fra de andre..
Der er fem varianter af tunge kæder, der bestemmer fem typer immunglobuliner, hvis funktioner er forskellige.
Immunglobulin G (IgG)
Immunoglobulin G er den mest talrige sort. Den har en gamma-tung kæde og forekommer i unimolekylær eller monomer form.
IgG er den mest forekommende både i blodserum og i vævsområdet. Minimale ændringer i aminosyresekvensen for dens tunge kæde bestemmer dens opdeling i undertyper: 1, 2, 3 og 4.
Immunoglobulin G har en sekvens på 330 aminosyrer i sit Fc-segment og en molekylvægt på 150.000, hvoraf 105.000 svarer til dets tunge kæde.
Immunglobulin M (IgM)
Immunoglobulin M er en pentamer, hvis tunge kæde er μ. Dens molekylvægt er høj, cirka 900.000.
Aminosyresekvensen for dens tunge kæde er 440 i sin Fc-fraktion. Det findes overvejende i blodserum, der repræsenterer 10 til 12% af immunglobuliner. IgM har kun én undertype.
Immunglobulin A (IgA)
Det svarer til den tunge kædetype α og repræsenterer 15% af de samlede immunglobuliner. IgA findes både i blod og sekreter, selv i modermælk, i form af en monomer eller dimer. Molekylvægten af dette immunglobulin er 320.000, og det har to undertyper: IgA1 og IgA2..
Immunglobulin E (IgE)
Immunglobulin E består af den tunge kæde af ε-typen og er meget knappe i serum, omkring 0,002%.
IgE har en molekylvægt på 200.000 og er til stede som en monomer primært i serum, næseslim og spyt. Det er også almindeligt at finde dette immunglobulin i basofiler og mastceller..
Immunglobulin D (IgD)
Sorten med tung kæde δ svarer til immunglobulin D, som repræsenterer 0,2% af det totale immunglobulin. IgD har en molekylvægt på 180.000 og er struktureret som en monomer.
Det er relateret til B-lymfocytter, der er bundet til deres overflade. Imidlertid er IgDs rolle uklar.
Ændring af type
Immunglobuliner kan gennemgå en strukturændring af typen på grund af behovet for at forsvare sig mod et antigen.
Denne ændring skyldes B-lymfocytteres rolle i dannelsen af antistoffer gennem egenskaben af adaptiv immunitet. Den strukturelle ændring er i den konstante region af den tunge kæde uden at ændre den variable region.
En type- eller klasseændring kan få et IgM til at skifte til IgG eller IgE, og dette sker som et respons induceret af interferon gamma eller interleukiner IL-4 og IL-5.
Funktioner
Den rolle, som immunglobuliner spiller i immunsystemet, er af vital betydning for kroppens forsvar.
Immunoglobuliner er en del af det humorale immunsystem; de er stoffer, der udskilles af celler til beskyttelse mod patogener eller skadelige stoffer.
De giver et effektivt middel til forsvar, effektivt, specifikt og systematiseret og er af stor værdi som en del af immunsystemet. De har generelle og specifikke funktioner inden for immunitet:
Generelle funktioner
Antistoffer eller immunglobuliner udfører både uafhængige funktioner og aktiverer cellemedieret effektor og sekretoriske reaktioner.
Antigen-antistofbinding
Immunglobuliner har funktionen af at binde antigene midler specifikt og selektivt.
Dannelsen af antigen-antistof-komplekset er hovedfunktionen for et immunglobulin, og det er derfor immunresponset, der kan stoppe antigenets virkning. Hvert antistof kan binde til to eller flere antigener på samme tid.
Effektorfunktioner
Det meste af tiden tjener antigen-antistof-komplekset som initiator til at aktivere specifikke cellulære reaktioner eller til at initiere en sekvens af begivenheder, der bestemmer eliminering af antigenet. De to mest almindelige effektorresponser er cellebinding og komplementaktivering..
Cellebinding afhænger af tilstedeværelsen af specifikke receptorer for Fc-segmentet af immunglobulinet, når det først er bundet til antigenet.
Celler såsom mastceller, eosinofiler, basofiler, lymfocytter og fagocytter har disse receptorer og tilvejebringer mekanismerne til eliminering af antigen..
Aktivering af komplementkaskaden er en kompleks mekanisme, der involverer begyndelsen af en sekvens, så slutresultatet er udskillelsen af giftige stoffer, der eliminerer antigener.
Specifikke funktioner
For det første udvikler hver type immunglobulin en specifik forsvarsfunktion:
Immunglobulin G
- Immunoglobulin G tilvejebringer det meste af forsvaret mod antigene midler, herunder bakterier og vira.
- IgG aktiverer mekanismer såsom komplement og fagocytose.
- Antigenspecifik IgG-forfatning er holdbar.
- Det eneste antistof, som moderen kan overføre til sine børn under graviditeten, er IgG.
Immunoglobulin M
- IgM er det hurtige responsantistof mod skadelige og infektiøse agenser, da det giver øjeblikkelig handling, indtil det erstattes af IgG.
- Dette antistof aktiverer cellulære reaktioner inkorporeret i lymfocytmembranen og humorale reaktioner såsom komplement..
- Det er det første immunglobulin, der er syntetiseret af mennesker.
Immunglobulin A
- Det fungerer som en forsvarsbarriere mod patogener ved at være placeret på overfladerne af slimhinderne.
- Det er til stede i luftvejsslimhinden, fordøjelsessystemet, urinvejen og også i sekreter som spyt, næseslim og tårer..
- Selvom dets komplementaktivering er lav, kan den associeres med lysozymer for at dræbe bakterier.
- Tilstedeværelsen af immunglobulin D i både modermælk og råmælk tillader en nyfødt at erhverve det under amning.
Immunglobulin E.
- Immunoglobulin E giver en stærk forsvarsmekanisme mod allergiproducerende antigener.
- Interaktionen mellem IgE og et allergen vil forårsage inflammatoriske stoffer, der er ansvarlige for symptomerne på allergier, såsom nysen, hoste, nældefeber, øgede tårer og næseslim..
- IgE kan også fastgøre sig til overfladen af parasitter gennem sit Fc-segment og producere en reaktion, der forårsager deres død..
Immunoglobulin D
- Den monomere struktur af IgD er bundet til B-lymfocytter, der ikke har interageret med antigener, og derfor spiller de rollen som receptorer.
- IgDs rolle er uklar.
Referencer
- (s.f.) Medicinsk definition af immunglobulin. Gendannet fra medicinenet.com
- Wikipedia (s.f.). Antistof. Gendannet fra en.wikipedia.org
- Grattendick, K., Pross, S. (2007). Immunoglobuliner. Gendannet fra sciencedirect.com
- Iáñez, E. (s.f.). Immunoglobuliner og andre B-celle molekyler Kursus i generel immunologi. Gendannet fra ugr.es
- (s.f.) Introduktion til immunglobuliner. Gendannet fra thermofisher.com
- Buddiga, P. (2013). Immunsystemets anatomi. Gendannet fra emedicine.medscape.com
- Biokemiske spørgsmål (2009). Immunoglobuliner: struktur og funktioner. Gendannet fra biochemistryquestions.wordpress.com
- (s.f.) Immunoglobuliner - struktur og funktion. Gendannet fra microbiologybook.org


Endnu ingen kommentarer