
Isobar-egenskaber, eksempler og forskelle med isotoper

Det isobarer Det er de atomarter, der har den samme masse, men som kommer fra forskellige kemiske grundstoffer. Som en konsekvens af dette kan det siges, at de består af forskellige antal protoner og neutroner.
Både protoner og neutroner er i kernen i deres atomer, men nettonet af neutroner og protoner, der er til stede i hver kerne, forbliver den samme. Med andre ord stammer en isobar art, når et par atomkerner viser det samme netantal neutroner og protoner for hver art..
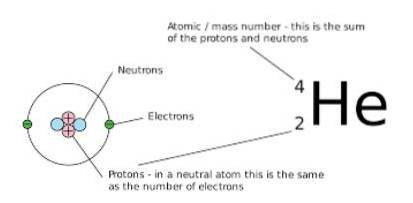
Antallet af neutroner og protoner, der udgør nettomængden, er imidlertid forskelligt. En måde at bemærke det grafisk på er at observere massetallet (som er placeret øverst til venstre på symbolet for det kemiske element, der er repræsenteret), fordi i isobarer er dette nummer det samme.
Artikelindeks
- 1 Funktioner
- 1.1 Repræsentation
- 2 Eksempler
- 3 Forskelle mellem isobarer og isotoper
- 4 Referencer
Egenskaber
For det første kommer betegnelsen isobarus etymologi fra de græske ord isos (hvilket betyder "lige") og baros (hvilket betyder "vægt"), der henviser til ligevægten mellem begge nukleare arter.
Det skal bemærkes, at isobarer har visse ligheder med andre arter, hvis kerner har sammenfald, såsom isotoner, som har det samme antal neutroner, men med forskellige massetal og atomnumre, såsom par 13C og 14Ikke 36S og 37Cl.
På den anden side er udtrykket "nuklid" det navn, der er blevet mønstret til hvert sæt af nukleoner (strukturer, der består af neutroner og protoner), der kan dannes.
Så nuklider muligvis skelnes af deres antal neutroner eller protoner eller endda af den mængde energi, som strukturen af deres konglomeration har..
Ligeledes opstår en datterkerne efter β-henfaldsprocessen, og dette er igen en isobar af moderkernen, fordi antallet af nukleoner, der er til stede i kernen, forbliver uændret i modsætning til hvad der sker ved hjælp af henfald α.
Det er vigtigt at huske, at forskellige isobarer har forskellige atomnumre, hvilket bekræfter, at de er forskellige kemiske grundstoffer..
Repræsentation
For at betegne de forskellige nuklider anvendes en specifik notation, som kan repræsenteres på to måder: den ene består i at placere navnet på det kemiske element efterfulgt af dets massenummer, som er forbundet med en bindestreg. For eksempel: nitrogen-14, hvis kerne består af syv neutroner og syv protoner.
Den anden måde at repræsentere disse arter på er at placere symbolet på det kemiske element, der er forud for et numerisk overskrift, der angiver massens nummer for det pågældende atom, samt et numerisk underskrift, der betegner dets atomnummer, som følger:
ZTILx
I dette udtryk repræsenterer X det kemiske element i det pågældende atom, A er massetallet (resultat af tilføjelsen mellem antallet af neutroner og protoner) og Z repræsenterer atomnummeret (lig med antallet af protoner i kernen af atom).
Når disse nuklider er repræsenteret, udelades atomnummeret (Z) normalt, fordi det ikke giver relevante yderligere data, så det repræsenteres ofte som TILx.
En måde at vise denne notation er ved at tage det foregående eksempel (nitrogen-14), som også betegnes som 14N. Dette er den betegnelse, der bruges til isobarer.
Eksempler
Brugen af udtrykket "isobarer" for arter kendt som nuklider, der har det samme antal nukleoner (lige stort antal) blev foreslået i slutningen af 1910'erne af den britiske kemiker Alfred Walter Stewart..
I denne rækkefølge af ideer kan et eksempel på isobarer observeres i tilfælde af arten 14C og 14N: massetallet er lig med 14, dette betyder, at antallet af protoner og neutroner i begge arter er forskelligt.
Faktisk har dette carbonatom et atomnummer, der er lig med 6, så der er 6 protoner i dets struktur, og til gengæld har det 8 neutroner i sin kerne. Så dens massetal er 14 (6 + 8 = 14).
For sin del har nitrogenatomet et atomnummer lig med 7, så det består af 7 protoner, men det har også 7 neutroner i sin kerne. Dets massetal er også 14 (7 + 7 = 14).
Du kan også finde en serie, hvor alle atomer har et massetal svarende til 40; dette er tilfældet med isobarer: 40AC, 40K, 40Ar, 40Cl og 40S.
Forskelle mellem isobarer og isotoper
Som tidligere forklaret beskriver nuklider de forskellige klasser af atomkerner, der findes i henhold til antallet af protoner og neutroner, de har..
Blandt disse typer nuklider er også isobarer og isotoper, som vil blive differentieret nedenfor.
I tilfældet med isobarer har de som nævnt det samme antal nukleoner - det vil sige det samme antal masser - hvor antallet af protoner, hvormed den ene art er større end den anden, stemmer overens med antallet af neutroner. er i underskud, så summen er den samme. Imidlertid er dets atomnummer forskelligt.
I denne forstand kommer isobar-arter fra forskellige kemiske grundstoffer, så de er placeret i forskellige rum i det periodiske system og har forskellige karakteristika og specifikke egenskaber..
På den anden side sker det i modsætning til isotoper det modsatte, da de har det samme atomnummer, men forskellige massemængder; det vil sige, de har det samme antal protoner, men et andet antal neutroner inde i deres atomkerner..
Derudover er isotoper atomarter, der hører til de samme elementer, så de er placeret i det samme rum i det periodiske system og har lignende karakteristika og egenskaber..
Referencer
- Wikipedia. (s.f.). Isobar (nuklid). Gendannet fra en.wikipedia.org
- Britannica, E. (s.f.). Isobar. Hentet fra britannica.com
- Konya, J. og Nagy, N. M. (2018). Nuklear og radiokemi. Gendannet fra books.google.co.ve
- Energiuddannelse. (s.f.). Isobar (nuklear). Hentet fra energyeducation.ca
- Tutor View. (s.f.). Kerner. Gendannet fra physics.tutorvista.com


Endnu ingen kommentarer