
Top 6 faktorer, der påvirker opløselighed
Vigtigste faktorer, der påvirker opløselighed De er polaritet, fælles ioneffekt, temperatur, tryk, opløste natur og mekaniske faktorer. Opløselighed er evnen hos et fast, flydende eller gasformigt kemikalie (kaldet opløst stof) til at opløses i et opløsningsmiddel (normalt en væske) og danne en opløsning..
Et stofs opløselighed afhænger hovedsageligt af det anvendte opløsningsmiddel samt af temperatur og tryk. Et stofs opløselighed i et bestemt opløsningsmiddel måles ved koncentrationen af den mættede opløsning.

En opløsning betragtes som mættet, når tilsætningen af yderligere opløst stof ikke længere øger koncentrationen af opløsningen..
Graden af opløselighed varierer meget afhængigt af stofferne, fra uendelig opløselig (fuldstændig blandbar), såsom ethanol i vand, til let opløselig, såsom sølvchlorid i vand. Udtrykket "uopløselig" anvendes ofte til dårligt opløselige forbindelser (Boundless, S.F.).
Visse stoffer er opløselige i alle forhold med et givet opløsningsmiddel, såsom ethanol i vand, denne egenskab er kendt som blandbarhed.
Under forskellige betingelser kan ligevægtens opløselighed overskrides for at give en såkaldt overmættet opløsning (Opløselighed, S.F.).
Vigtigste faktorer, der påvirker opløselighed
1- Polaritet
I de fleste tilfælde opløses opløste stoffer i opløsningsmidler, der har en lignende polaritet. Kemikere bruger en populær aforisme til at beskrive denne egenskab ved opløste stoffer og opløsningsmidler: "som opløses som".
Ikke-polære opløste stoffer opløses ikke i polære opløsningsmidler og omvendt (Uddannelse online, S.F.).
2- Effekt af den fælles ion
Den fælles ioneffekt er et udtryk, der beskriver faldet i en ionforbindelses opløselighed, når et salt, der indeholder en ion, der allerede findes i kemisk ligevægt, tilsættes til blandingen..
Denne effekt forklares bedst ved Le Châteliers princip. Forestil dig, om den let opløselige ioniske forbindelse calciumsulfat, CaSO4, tilsættes til vandet. Den netto ioniske ligning for den resulterende kemiske ligevægt er som følger:
CaSO4 (s) ⇌Ca2 + (aq) + SO42− (aq)
Calciumsulfat er let opløseligt. Ved ligevægt eksisterer det meste af calcium og sulfat i fast form af calciumsulfat..
Antag, at den opløselige ioniske forbindelse kobbersulfat (CuSO4) blev tilsat til opløsningen. Kobbersulfat er opløseligt; Derfor er dens eneste store effekt på nettoionligningen tilsætningen af flere sulfationer (SO4to-).
CuSO4 (s) ⇌Cu2 + (aq) + SO42− (aq)
Sulfationer adskilt fra kobbersulfat er allerede til stede (fælles for) i blandingen fra let dissociation af calciumsulfat.
Derfor understreger denne tilsætning af sulfationer den tidligere etablerede ligevægt.
Le Chateliers princip dikterer, at den ekstra stress på denne side af ligevægtsproduktet resulterer i ligevægtsskiftet mod reaktantsiden for at lindre denne nye stress..
På grund af skiftet mod reaktantsiden reduceres opløseligheden af let opløseligt calciumsulfat yderligere (Erica Tran, 2016).
3- Temperatur
Temperatur har en direkte indvirkning på opløseligheden. For de fleste ioniske faste stoffer øges temperaturforøgelsen, hvor hurtigt løsningen kan fremstilles.
Når temperaturen stiger, bevæger partiklerne i det faste stof sig hurtigere, hvilket øger chancerne for, at de interagerer med flere partikler af opløsningsmidlet. Dette resulterer i en stigning i hastigheden, hvormed en opløsning produceres..
Temperatur kan også øge den mængde opløst stof, der kan opløses i et opløsningsmiddel. Generelt, når temperaturen stiger, opløses flere opløste partikler.
For eksempel er tilsætning af bordsukker til vand en nem metode til at lave en løsning. Når denne opløsning opvarmes, og sukker tilsættes, viser det sig, at der kan tilsættes store mængder sukker, når temperaturen fortsætter med at stige..
Årsagen til dette er, at når temperaturen stiger, kan de intermolekylære kræfter lettere brydes, så flere opløste partikler kan tiltrækkes af opløsningsmiddelpartiklerne..
Der er dog andre eksempler, hvor temperaturforøgelse har meget ringe effekt på, hvor meget opløst stof, der kan opløses..
Bordsalt er et godt eksempel: du kan opløse næsten den samme mængde bordsalt i isvand som du kan i kogende vand..
Når temperaturen stiger, falder opløseligheden for alle gasser. Kinetisk molekylær teori kan bruges til at forklare dette fænomen..
Når temperaturen stiger, bevæger gasmolekylerne sig hurtigere og er i stand til at flygte fra væsken. Gasopløseligheden falder derefter.
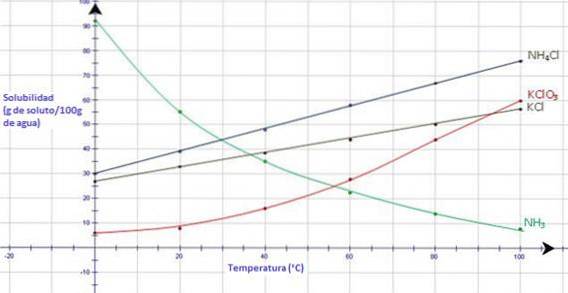
Ser man på nedenstående graf viser ammoniakgas, NH3, et stærkt fald i opløselighed, når temperaturen stiger, mens alle ioniske faste stoffer viser en stigning i opløselighed, når temperaturen stiger (CK-12 Foundation, S.F.).
4- Tryk
Den anden faktor, tryk, påvirker opløseligheden af en gas i en væske, men aldrig af et fast stof, der opløses i en væske..
Når der påføres tryk på en gas, der er over overfladen af et opløsningsmiddel, vil gassen bevæge sig ind i opløsningsmidlet og optage nogle af mellemrummene mellem opløsningsmiddelpartiklerne..
Et godt eksempel er kulsyreholdig sodavand. Der anvendes tryk for at tvinge CO2-molekylerne ind i sodavand. Det modsatte gælder også. Når gasens tryk falder, falder også gasens opløselighed.
Når en sodavand åbnes, falder trykket i sodavand, så gassen straks begynder at komme ud af opløsningen.
Kuldioxid, der er lagret i sodavand, frigives, og du kan se svimmel på overfladen af væsken. Hvis du efterlader en åben sodavand i en periode, kan du bemærke, at drikken bliver flad på grund af tabet af kuldioxid.
Denne gastrykfaktor er udtrykt i Henrys lov. Henrys lov fastslår, at opløseligheden af en gas i en væske ved en given temperatur er proportional med gasens partielle tryk over væsken.
Et eksempel på Henrys lov forekommer i dykning. Når en person dykker ned i dybt vand, stiger trykket, og flere gasser opløses i blodet.
Mens den stiger fra et dybt vanddyk, skal dykkeren vende tilbage til vandoverfladen med en meget langsom hastighed for at tillade alle de opløste gasser at forlade blodet meget langsomt.
Hvis en person stiger for hurtigt op, kan der opstå en medicinsk nødsituation på grund af gasser, der forlader blodet for hurtigt (Papapodcasts, 2010).
5- Opløsningens art
Opløselighedens art og opløsningen og tilstedeværelsen af andre kemiske forbindelser i opløsningen påvirker opløseligheden..
For eksempel kan mere sukker opløses i vand end salt i vand. I dette tilfælde siges det, at sukker er mere opløseligt.
Ethanol i vand er fuldstændigt opløselige med hinanden. I dette særlige tilfælde vil opløsningsmidlet være den forbindelse, der findes i den største mængde.
Størrelsen af det opløste stof er også en vigtig faktor. Jo større de opløste molekyler er, desto større er dens molekylvægt og størrelse. Det er sværere for opløsningsmiddelmolekyler at omgive større molekyler.
Hvis alle ovennævnte faktorer er udelukket, kan en generel tommelfingerregel findes, at større partikler generelt er mindre opløselige..
Hvis trykket og temperaturen er den samme som mellem to opløste stoffer med samme polaritet, er den med mindre partikler normalt mere opløselig (faktorer, der påvirker opløselighed, S.F.).
6- mekaniske faktorer
I modsætning til opløsningshastigheden, som hovedsageligt afhænger af temperaturen, afhænger omkrystallisationshastigheden af den opløste koncentration på overfladen af krystalgitteret, hvilket foretrækkes, når en opløsning er ubevægelig.
Omrøring af opløsningen forhindrer derfor denne ophobning og maksimerer opløsning. (mætningsrør, 2014).
Referencer
- (S.F.). Opløselighed. Gendannet fra boundles.com.
- CK-12 Foundation. (S.F.). Faktorer, der påvirker opløselighed. Gendannet fra ck12.org.
- Uddannelse online. (S.F.). Faktorer, der påvirker opløselighed. Gendannet fra solubilityofthings.com.
- Erica Tran, D. L. (2016, 28. november). Opløselighed og faktorer, der påvirker opløselighed. Gendannet fra chem.libretexts.org.
- Faktorer, der påvirker opløselighed. (S.F.). Gendannet fra sciencesource.pearsoncanada.ca.
- (2010, 1. marts). Faktorer, der påvirker opløselighed del 4. Gendannet fra youtube.com.
- Opløselighed. (S.F.). Gendannet fra chemed.chem.purdue.ed.
- mætningsrør. (2014, 26. juni). Gendannet fra kemi libretex.org.



Endnu ingen kommentarer