
Medium MIO fundament, forberedelse og anvendelser
Det halv MIO er en biokemisk test, der bruges til at identificere arter af bakterier, der tilhører Enterobacteriaceae-familien. Det er ret nærende og består af glukose, gærekstrakt, pepton, triptein, L-ornithinhydrochlorid, bromocresol lilla og agar.
Betydningen af dets akronym (MIO) beskriver hver af de parametre, der kan observeres i dette medium; bevægelighed, indol og ornitin. Motilitet er mikroorganismens evne til at bevæge sig på grund af tilstedeværelsen af flagella. For at denne egenskab skal overholdes, skal mediumets konsistens være halvfast, så præparatet indeholder mindre agar..
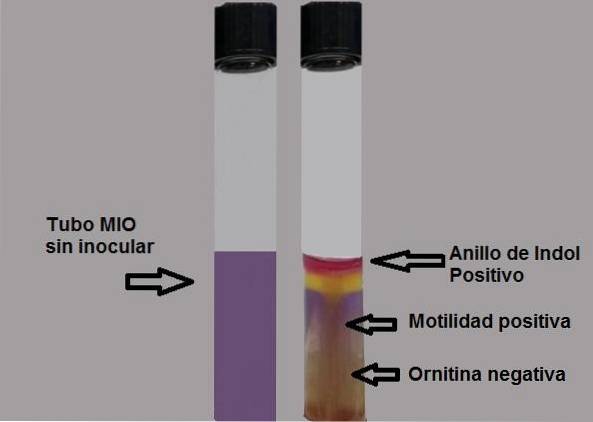
Produktionen af indol viser tilstedeværelsen af enzymet tryptophanase, der virker på aminosyren tryptophan, hvilket kræver brug af et afslørende reagens for at gøre produktionen af indol synlig..
Endelig bestemmer ornithin, om bakterien er i stand til at decarboxylere aminosyren, dvs. om den har enzymet orinithindecarboxylase.
Artikelindeks
- 1 begrundelse
- 1.1 Pepton, gærekstrakt og triptein
- 1.2 Motilitet
- 1.3 Glukose
- 1,4 L-ornitin
- 1,5 pH-indikator
- 2 Såning og udvikling af teknik
- 3 Forberedelse
- 3.1 MIO-medium
- 3.2 Kovacs-reagens (udvikler af indoletest)
- 4 Brug
- 5 Kvalitetskontrol
- 6 Referencer
Basis
Pepton, gærekstrakt og triptein
Disse elementer bidrager til næringsstyrken i dette medium. De tjener som en kilde til næringsstoffer og essentielle aminosyrer til bakteriel udvikling.
Derudover er triptein en kilde til tryptophan for at demonstrere tilstedeværelsen af enzymet tryptophanase, der nedbryder tryptophan ved reduktiv deaminering, hvilket frigiver indol, pyruvinsyre, ammoniak og energi..
Indol er farveløs, derfor afsløres dets tilstedeværelse ved tilsætning af fem dråber Ehrlichs eller Kovacs reagens, begge med p-dimethylaminobenzaldehyd..
Aldehydgruppen i denne forbindelse reagerer med indol og danner et ringformet, fuchsia-rødt produkt på overfladen af agaren..
Ethvert spor af farve skal betragtes som en positiv test. Beviset skal læses med det samme, da farven nedbrydes over tid.
Desuden skal denne test afsløres, efter at ornithins motilitets- og decarboxyleringsresultater er blevet noteret..
Fortolkning
Positiv test: dannelse af en fuchsia-rød ring, når der tilsættes dråber af Kovacs reagens.
Negativ test: ingen ringdannelse.
Motilitet
Bakteriens evne til at bevæge sig vil blive påvist, hvis der observeres et uklart medium, eller hvis der er en tyk vækstlinje, der udvider sig omkring den første podning..
En negativ motilitetstest vil fremgå ved at observere en tynd vækstlinje, og alt omkring den vil være uden vækst..
Det er vigtigt, at motiliteten læses, inden indolen afsløres, da tilsætningen af reagenset skyder hele mediet..
I mobile, men langsomt voksende bakterier er det vanskeligt at demonstrere deres bevægelighed med dette medium. I dette tilfælde anbefales det at bruge andre tests eller metoder, såsom medium bevægelighed eller drop-ventende metode..
Glukose
Glucose er det fermenterbare kulhydrat, der ud over at give energi også forsyrer miljøet, en nødvendig betingelse for, at decarboxyleringen af aminosyren ornithin kan forekomme..
Glukosefermentering skal altid forekomme med udgangspunkt i princippet om, at alle bakterier, der tilhører Enterobacteriaceae-familien, fermenterer glukose..
L-Ornithine
I tilfælde af at bakterierne producerer enzymet ornithindecarboxylase, kan dette virke, når mediet er blevet forsuret ved gæring af glucose..
Enzymet ornithindecarboxylase virker på aminosyrens carboxylgruppe, der producerer en amin kaldet putresin, der alkaliserer mediet igen.
Denne test skal læses efter 24 timers inkubation, for hvis du prøver at læse før, kan du fejlagtigt fortolke testen med en falsk negativ.
Det skal huskes, at den første reaktion, der opstår, er gæring af glucose, hvorfor mediet bliver gult i en indledende fase (første 10 til 12 timer). Hvis der derefter opstår ornitindecarboxylering, bliver mediet lilla.
Det er vigtigt at fortolke ornitindecarboxyleringstesten, før indol afsløres, da tilsætningen af Kovacs reagens ændrer farven på mediet..
Fortolkning
Negativ test: gul medium eller gul baggrund.
Positiv test: halvt helt lilla.
PH-indikator
I dette tilfælde anvendes bromocresol lilla; den, der har ansvaret for at afsløre, når der er en ændring i pH i mediet. Når den syrnes, bliver indikatoren gul, og når den er alkaliseret, bliver den lilla.
Såning og udvikling af teknik
For at så MIO-mediet bruges en lige sløjfe eller nål, og med den indsamles en del af kolonien, der skal undersøges..
En dyb punktering foretages midt i MIO i en lige linje. Det tilrådes ikke at udføre en dobbelt punktering, da det kan give et falsk billede af bevægelighed, hvis punktering ikke udføres på samme sted.
Inkuber i 24 til 48 timer ved 37 ° C i aerobiose. Overhold resultaterne i denne rækkefølge: motilitet, decarboxylering af ornitinet og afslør endelig indolen.
Det tilrådes at aseptisk fjerne 2 ml af mediet, overføre det til et sterilt rør og udføre indolprøven der, så hvis resten er original, kan den inkuberes i yderligere 24 timer for at afsløre indol igen..
Udviklingen af indolen udføres som følger: 3 til 5 dråber Kovacs reagens sættes til MIO-mediet, og det rystes kraftigt. Det observeres, om der vises en rød fuchsia-ring.
Forberedelse
Medium MIO
Vej 31 g af MIO-mediet op og opløses i en liter destilleret vand..
Varm op, indtil blandingen koger i et minut og ryster ofte, indtil agaren er helt opløst. Fordel 4 ml af mediet i 13/100 reagensglas med bomuldshætter.
Steriliseres i autoklave ved 121 ° C i 15 minutter. Fjern fra autoklaven, og lad den stå lige i et stativ på en sådan måde, at der dannes en halvfast blok.
Opbevares i køleskab 2-8 ° C. Lad det varme op, før bakteriestammen sås.
Farven på det dehydratiserede medium er beige og det præparerede medium let opaliserende lilla..
Den endelige pH i det fremstillede medium er 6,5 ± 0,2
Mediet bliver gul ved sur pH og er lilla ved alkalisk pH.
Kovacs Reagent (Indole Test Developer)
Dette reagens fremstilles som følger:
150 ml amyl, isoamyl eller butylalkohol (hvilken som helst af de tre) måles. 10 g p-dimethylaminobenzaldehyd opløses i den. Derefter tilsættes langsomt 50 ml koncentreret saltsyre..
Det tilberedte reagens er farveløst eller lysegult. Det skal opbevares i en ravfarvet flaske og opbevares i køleskab. En mørkebrun farve viser dens forværring.
Kovacs-reagenset kan også erstatte Ehrlich-reagenset. Sidstnævnte, som er mere følsom, foretrækkes at afsløre indol i bakterier, der producerer den i små mængder, såsom i nogle ikke-fermenterende gramnegative stænger og visse anaerober..
Brug
Dette medium er en test, der supplerer et batteri af biokemiske tests til identifikation af bakterier, der tilhører Enterobacteriaceae-familien..
Dataene for decarboxylering af ornithin tjener til at skelne mellem Shigella sonnei, det giver positivt, af Shigella boydii, Shigella flexneri og S. dysenterieae, der giver negativer.
Det skelner også slægten Klebsiella, som tester negativt, fra slægten Enterobacter, hvor de fleste af dens arter tester positive..
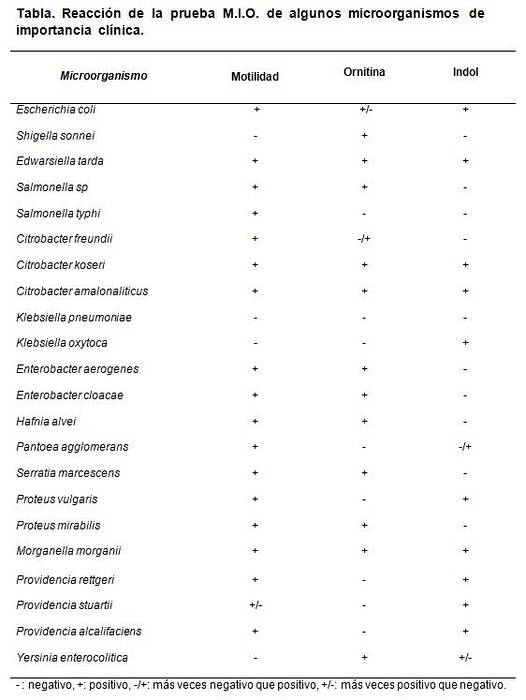
QA
Hver gang et parti MIO-medium fremstilles, kan der udføres en kontroltest. Til dette anvendes kendte eller certificerede stammer til at observere mediumets opførsel..
De stammer, der kan bruges er Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes Y Proteus mirabilis.
De forventede resultater er E. coli og M. morganii. Dan M: +, I: + og O: +.
Klebsiella pneumoniae giver alle negative (M: -, I: -, O :-). Proteus mirabilis Y Enterobacter aerogenes give M: + I: - og O: +.
Referencer
- Mac Faddin J. (2003). Biokemiske tests til identifikation af bakterier af klinisk betydning. 3. udgave Redaktionel Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Redaktionel Panamericana S.A. Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. udgave Redaktionel Panamericana S.A. Argentina.
- Britannia Laboratories. MIO Medio 2015. Tilgængelig på: britanialab.com
- BD Laboratories. BBL Motility Indole Ornithine (MIO) Medium. 2007. Fås på: bd.com
- Valtek Laboratories. Medium M.I.O. Motilitet, indol, ornitin. 2010. Tilgængelig på: andinamedica.com

Endnu ingen kommentarer