
Myoglobinstruktur, funktion, normale værdier
Det myoglobin Det er et kugleformet intracellulært protein, der findes i cytosolen i skelet- og hjertemuskelceller. Dets grundlæggende funktion er at udgøre en iltreserve og fremme den intracellulære transport af ilt..
John Kendrew og Max Perutz modtog Nobelprisen i kemi i 1962 for deres studier af kugleformede proteiner. Disse forfattere belyste den tredimensionale struktur af henholdsvis myoglobin og hæmoglobin. Historisk set var myoglobin et af de første proteiner, hvorfra den tredimensionelle struktur blev bestemt..
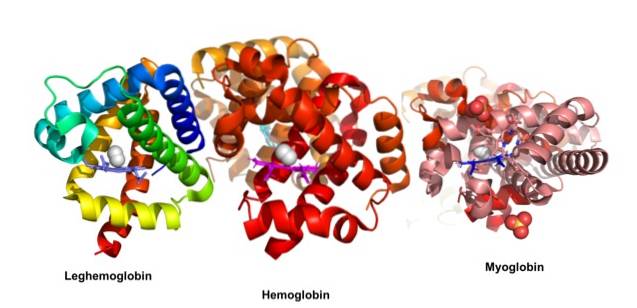
Globulære proteiner er kompakte molekyler med en sfærisk form; de er opløselige i cytosolen eller i lipiddelen af cellemembraner. De er ansvarlige for de vigtigste biologiske handlinger i modsætning til fibrøse proteiner, hvis hovedfunktioner er strukturelle.
Myoglobin giver frisk kød sin røde farve. Dette sker, når myoglobin iltes som oxymyoglobin, og det jern, der komponerer det, er i form af jernholdigt jern: Mb-Fe2 + O2.
Når kødet udsættes for miljøet, oxiderer det ustabile jernholdige jern og bliver jern, og under disse betingelser skifter farven til brune toner på grund af dannelsen af methamyoglobin (Mb-Fe3 + + O2 ● -).
Normalt er blodmyoglobinniveauerne meget små i størrelsesordenen mikrogram pr. Liter (μg / L). Disse niveauer stiger, når muskeldestruktion opstår som ved rhabdomyolyse i skeletmuskulatur eller i hjerteinfarkt med vævsdestruktion og i nogle myopatier..
Dens tilstedeværelse i urinen observeres under visse forhold, hvor vævsskader er meget vigtige. Dens tidlige diagnostiske værdi for hjerteanfald kan diskuteres.
Artikelindeks
- 1 Struktur af myoglobin
- 2 Funktion
- 2.1 Typer af muskelfibre og myoglobin
- 3 Normale værdier
- 4 Referencer
Struktur af myoglobin
Myoglobin har en molekylvægt på næsten 18 kDa inklusive hæmgruppen. Den består af fire spiralformede segmenter, der er forbundet med "skarpe vendinger". Disse myoglobinhelixer er tæt pakket og opretholder deres strukturelle integritet, selv når hæmgruppen fjernes..
Strukturen af kugleformede proteiner såvel som af alle cellulære proteiner er hierarkisk, så strukturen af myoglobin er også hierarkisk. Det første niveau er den primære struktur dannet af den lineære sekvens af aminosyrer, og myoglobin udgøres af en kæde på 153 aminosyrer..
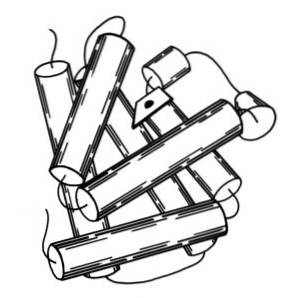
Den sekundære struktur af myoglobin består af konformationen af alpha helices. Myoglobin indeholder 8 alfa-helixer dannet ved at gentage polypeptiddele, der er forbundet med korte segmenter af aperiodisk arrangement..
Den tertiære struktur består af den tredimensionelle konformation med biologisk aktivitet. De vigtigste egenskaber ved denne struktur er foldene. Den kvaternære struktur henviser til samlingen af to eller flere polypeptidkæder adskilt og forbundet med ikke-kovalente bindinger eller interaktioner..
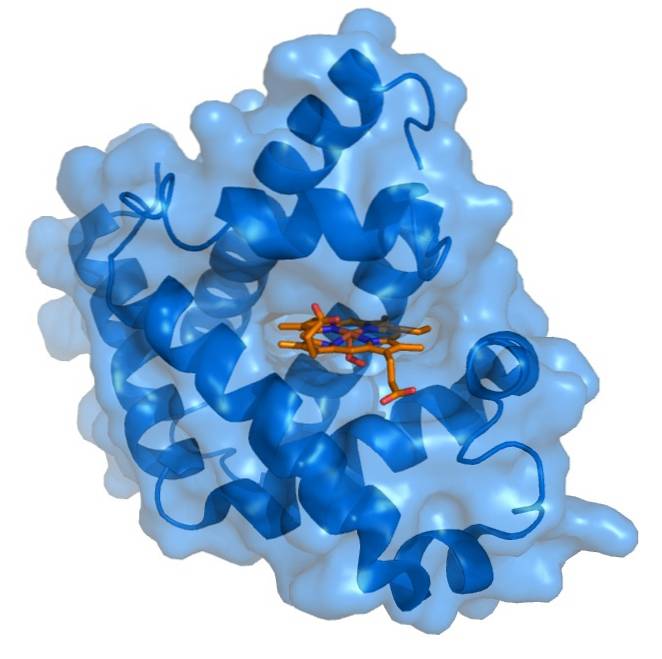
Myoglobin har en meget kompakt struktur med hydrofobe rester rettet indad og hydrofile eller polære rester rettet udad. De indre apolære rester består af leucin, valin, methionin og phenylalanin. De eneste interne polære rester er to histidiner, der har funktioner i det aktive center..
Hæmprotesegruppen er placeret i en kløft i den apolare indre del af polypeptidkæden af myoglobin. Denne gruppe indeholder jern i form af jern, der binder med ilt til dannelse af oxymyoglobin..
Fungere
Myoglobins funktion er at binde ilt til hæmgruppen i dets struktur og danne en iltreserve til muskelfunktion. Da ilt er fanget i myoglobinstrukturen i cytoplasmaet i muskelcellen, forbliver dets intracellulære tryk, bestemt af frit ilt, lavt..
Lavt intracellulært iltryk opretholder gradienten for iltindtrængning i cellen. Dette favoriserer passage af ilt fra blodbanen til muskelcellen. Når myoglobin er mættet, øges intracellulært ilt, hvilket gradvist nedsætter gradienten og dermed mindsker overførslen.
Bindingskurven for ilt til myoglobin er hyperbolsk. I de indledende dele af kurven frembringer små ændringer i partialtrykket af ilt store ændringer i mætning af myoglobin med ilt..
Efterhånden som det iltlige partialtryk øges, fortsætter mætningen med at stige, men langsommere, det vil sige, er der behov for en meget større stigning i iltens delvise tryk for at øge mætning af myoglobin, og progressivt bliver kurven fladtrykt.
Der er en variabel, der måler affiniteten for kurven kaldet P50, dette repræsenterer det partialtryk af ilt, der er nødvendigt for at mætte myoglobinet indeholdt i en opløsning med 50%. Således, hvis P50 stiger, siges det, at myoglobin har mindre affinitet, og hvis P50 falder, siges det, at myoglobin har en højere affinitet for ilt..
Når iltbindingskurverne for myoglobin og hæmoglobin undersøges, observeres det, at for ethvert undersøgt iltryk, bliver myoglobin mere mættet end hæmoglobin, hvilket indikerer, at myoglobin har en højere affinitet for ilt end hæmoglobin.
Typer af muskelfibre og myoglobin
Skeletmuskler har forskellige typer muskelfibre i deres sammensætning, nogle kaldes langsom-ryk og andre hurtig-ryk. Hurtige trækfibre er strukturelt og metabolisk tilpasset til at trække sig sammen hurtigt og kraftigt og anaerobt.
Langsomme trækfibre er tilpasset til langsommere, men længere sammentrækninger, der er typiske for aerob træningsevne. En af de strukturelle forskelle mellem disse fibre er koncentrationen af myoglobin, som giver dem navnet hvide og røde fibre..
Røde fibre har et højt indhold af myoglobin, hvilket giver dem deres røde farve, men giver dem også mulighed for at opretholde store mængder ilt, hvilket er vigtigt for deres funktion..
Normale værdier
Normale blodværdier for mænd er 19 til 92 µg / l og for kvinder 12 til 76 µg / l, men der er forskelle i værdierne i de forskellige laboratorier..
Disse værdier stiger, når muskeldestruktion opstår, som forekommer i rhabdomyolyse i skeletmuskler, ved omfattende forbrændinger, elektriske stød eller i omfattende muskelnekrose på grund af arteriel okklusion, i hjerteinfarkt og i nogle myopatier..
Under disse forhold vises myoglobin i urinen og giver det en karakteristisk farve..
Referencer
- Fauci, A. S., Kasper, D. L., Hauser, S. L., Jameson, J. L. og Loscalzo, J. (2012). Harrisons principper for intern medicin. D. L. Longo (red.). New York: Mcgraw-hill
- Ganong WF: Central regulering af visceral funktion, i Gennemgang af medicinsk fysiologi, 25. udgave New York, McGraw-Hill Uddannelse, 2016.
- Guyton AC, Hall JE: Body Fluid Compartments: Ekstracellulære og intracellulære væsker; Ødem, i Lærebog i medicinsk fysiologi, 13. udgave, AC Guyton, JE Hall (red.). Philadelphia, Elsevier Inc., 2016.
- McCance, K. L. og Huether, S. E. (2018). Pathophysiology-Ebook: det biologiske grundlag for sygdom hos voksne og børn. Elsevier Health Sciences.
- Murray, R. K., Granner, D. K., Mayes, P. A., og Rodwell, V. W. (2014). Harpers illustrerede biokemi. Mcgraw-hill.



Endnu ingen kommentarer