
Myosin egenskaber, struktur, typer og funktion
Det myosin det er en molekylær motor, protein af natur, i stand til at bevæge sig på actinfilamenter i cytosolen. Den energi, der driver forskydningen af myosin, kommer fra hydrolyse af ATP. På grund af dette defineres myosin ofte som et mekanokemisk enzym.
I eukaryoter er myosin et meget rigeligt protein. Der er forskellige klasser af myosin, som er kodet af en familie af gener. I gær skelnes der mellem 5 klasser, mens der i pattedyr er beskrevet dusinvis.
Myosin har en lang række funktioner. Myosin I deltager sammen med actin i bevægelsen af keratocytter.
Myosin II tilvejebringer stivhed til plasmamembranen, deltager i cytokinese og muskelsammentrækning. Begge myosiner I og II samarbejder med cellemigrering. Myosiner I og V udfører vesikeltransport langs actinfilamenter.
Artikelindeks
- 1 Struktur
- 2 funktioner
- 3 funktioner
- 3.1 Muskelsammentrækning
- 3.2 Cytokinesis
- 3.3 Afstivning af kortikale membraner
- 3.4 Celleadhæsion
- 3.5 Forskydning af nogle vesikler
- 4 Sygdomme relateret til myosin
- 4.1 Myosiner og høretab
- 4.2 Myosin X og kræft
- 5 Referencer
Struktur
I elektronmikrofotografier har den typiske struktur af myosin-isoformer tre domæner: hoved, nakke og hale. Ved hydrolyse med chymotrypsin opnås et segment bestående af hoved og hals, kaldet tung meromyosin (HMM), og et segment af halen, kaldet let meromyosin (LMM).
Hoveddomænet er den N-terminale ende af den tunge kæde, og haledomænet er den C-terminale ende af den lette kæde.
Klasserne af myosin kan differentieres ved antallet af polypeptidkæder, der sammensætter det, og overflod og klasse af let kæde fastgjort til halsen.
Myosin I har en polypeptidkæde, der danner et hoved, og halen mangler alfa-spiralformede områder. Mens myosiner I og V har to polypeptidkæder og danner derfor to hoveder og en hale, hvor de spiralformede alfakæder er viklet til at danne en stavlignende struktur.
Myosiner I og V har bindingssteder for calmodulin, som regulerer og binder Ca+to, på lette kæder. Myosin I retter Ca+to i lette kæder, men gør det anderledes end calmodulin.
Egenskaber
På det mekanokemiske niveau har myosiner tre karakteristika, nemlig:
- Myosinhovedet er det motoriske domæne, der skrider frem i diskrete trin: Myosinhovedets forening til et actinfilament, dets tilbøjelighed og efterfølgende adskillelse producerer myosins bevægelse. Denne proces er cyklisk og afhænger af ATP.
- Konforme ændringer: hydrolysen af et ATP-molekyle er koblet til hvert trin i et myosinmolekyle gennem niveauer af amplifikation og transmission. Dette involverer store konformationsændringer af myosin..
Det første amplifikationsniveau produceres ved tabet af gamma-phosphatgruppen i ATP, hvilket muliggør en reorganisering af de strukturelle elementer i ATP-bindingsstedet. Denne omorganisering er koordineret med strukturelle ændringer i det actin-bindende sted..
Det andet amplifikationsniveau involverer kommunikation af konformationsændringen i det aktive sted til strukturelle komponenter i carboxylterminalen..
- Direktionalitet: Myosiner har vist sig at have polaritet eller omvendt retningsretning mod (+) enden af actinfilamentet. Denne konklusion kommer fra actin filament slip eksperimenter ved hjælp af fluorescens lysmikroskop..
Funktioner
Myosin deltager sammen med actin i muskelsammentrækning, celleadhæsion, cytokinese, afstivning af kortikale membraner og forskydning af nogle vesikler, blandt andre funktioner..
Defekter i myosin kan producere patologiske tilstande. For eksempel er defekter i myosinerne I og V relateret til henholdsvis myosinmyopatier og pigmenteringsforstyrrelser (Griscelli syndrom). Mens lidelser i myosin VI isoformer forårsager høretab.
Muskelsammentrækning
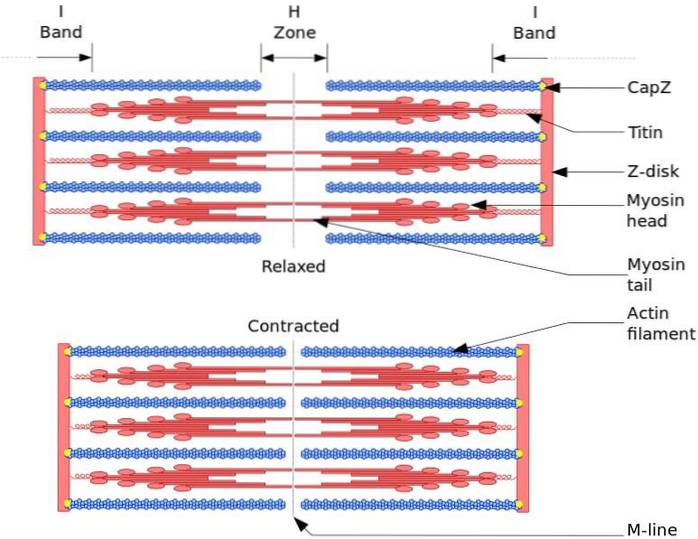
Den funktionelle og strukturelle enhed af skeletmuskulaturen er sarkomeren. Under muskelsammentrækning når sarkomeren 30% af dens oprindelige længde.
Sarcomerer består af tykke myosinfilamenter og tynde actinfilamenter, der er organiseret på en kompleks måde. Generelt er myosinhovederne placeret i de distale ender af glødetråden og deres haler mod midten af sarkomeren, og organisationen er bipolar.
For at muskelsammentrækning skal forekomme, skal myosinhovederne i modsatte ender bevæge sig mod Z-skiven eller (+) enden af filamentet. Fordi organisationen af de tykke filamenter er bipolar, sker glidningen af de tynde filamenter på de tykke filamenter, drevet af ATP.
Forskydningskraften opstår, fordi hundreder af myosinhoveder, af tykt filament, interagerer med et tyndt filament.
Cytokinesis
Under mitose, når mikrotubuli ved spindelpolerne adskilles, danner actin og myosin II en kontraktil ring ved cellens ækvator. Denne ring trækker sig sammen, mindsker dens diameter og deler cellen i to dele..
Afstivning af kortikale membraner
I mutantceller, der mangler myosin II, deformeres plasmamembranen let, når en ekstern kraft påføres. Dette sker, fordi myosin II tilvejebringer aggregeringskraft til plasmamembranproteiner..
Celleadhæsion
I epitelvæv er de kontraktile bundter af actin og myosin II placeret i nærheden af plasmamembranen og danner en cirkulær bælte, der omgiver den indre celleoverflade. Denne cirkulære bælte bestemmer celleformen og opretholder båndet mellem celler..
Kontakten mellem celler sker ved forening af det cirkulære bælte til de cellulære adhæsionsmolekyler ved hjælp af foreningsproteiner.
Forskydning af nogle vesikler
Eksperimentelle beviser afslører, at myosin V udfører membrantransport fra Golgi-apparatet til cellens periferi. Nogle beviser er:
- I nervøse vævsceller blev det ved astrocytimmunfluorescens fundet, at myosin V er placeret ved siden af Golgi.
- I gær forstyrrer mutationer i myosin V-genet proteinudskillelsen, og der akkumuleres derfor protein i cytosolen.
- Myosin I-isoformerne er ansvarlige for transporten af vakuoler mod cellemembranen. Ved anvendelse af specifikke antistoffer mod myosin I-isoformer blev det fundet, at disse isoformer er placeret i forskellige dele af cellen..
For eksempel når en levende amøbe er mærket med et antistof mod myosin IC, stoppes transporten af vakuolen til membranen. På grund af dette ekspanderer vakuolen, og cellen brister.
Myosin-relaterede sygdomme
Myosiner og høretab
Der er mange gener og mutationer, der forårsager høretab. Denne sygdom er ofte monogenetisk .
Ukonventionelle myosinmutationer med et eller to myosinhoveder påvirker funktionen af det indre øre. Nogle af de muterede myosin-isoformer er myosin IIIA, myosin VIIA og myosin XVA. For nylig blev der opdaget to mutationer i myosin VI.
Mutationer i myosin VI er c.897G> T og s.926Q. Den første mutation påvirker en region, der interagerer med det aktive sted, kaldet Switch I. Homozygot for mutationen udviser fænotypen tidligt og forårsager alvorlige effekter.
Den anden mutation påvirker et område af ladede rester i en alfa-helix i halen af myosin VI. Denne region er vigtig for proximal motordimerisering og påvirker den stereo-ciliære funktion af myosin VI..
En anden mutation er p.Asn207Ser, der producerer en motor, der ikke er i stand til at producere kraft. Dette skyldes, at Asn 207 er en aminosyrerest af det aktive sted, hvis funktion er binding og hydrolyse af ATP.
P.Arg657Trp-mutationen forårsager tab af myosin VI-funktion. Arg-resten er involveret i de konformationsændringer, der kobler hydrolyse til myosins bevægelse.
Myosin X og kræft
Myosin X (Myo10) er et ukonventionelt myosin, der udtrykkes i hjernen, endotel og mange epitelier. Myo10 og tre klasser af actin-baserede fremskrivninger (filopodia, invadopodia og filopodia-lignende fremskrivninger) arbejder under kræftmetastase.
Invasive kræftceller har et stort antal filopodia og udtrykker høje niveauer af fascina. Dette protein danner tværbindinger mellem actinfilamenter. For at undslippe den primære tumor dannes invadopodia, rig på proteolytisk aktivitet, der fordøjer den omgivende ekstracellulære matrix..
Når cellerne når den ekstracellulære matrix, hjælper de filopodia-lignende fremspring med at sprede sig og kolonisere. Høje niveauer af Myo10 indikerer høj aggressivitet og metastase i brystkræft.
MyoX-dæmpning medfører tab af metastatisk karakter af celler, som ikke er i stand til at danne actin-baserede fremskrivninger. Alle disse fremskrivninger har integrinbaserede adhæsioner, som bæres af Myo10 i filopodiet..
MyoX er involveret i dannelsen af centrosomet. Fraværet af MyoX favoriserer dannelsen af multipolære spindler. MyoX er også involveret i signalering i kræftceller. For eksempel aktiveres MyoX af 3,4,5, -inositoltriphosphat (PIP3).
Referencer
- Alberts, B., Johnson, A., Lewis, J., et al. 2007. Cellens molekylærbiologi. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Nye myosinmutationer for arveligt høretab afsløret ved målrettet genomisk indfangning og massiv parallel sekventering. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. og Cheney, R.E. 2015. Myosin-X og sygdom. Eksperimentel celleforskning, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cellulær og molekylærbiologi. Redaktionel Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Schliwa, M. og Woehlke, G. 2003. Molekylære motorer. Nature, 422: 759-765.
- Okay, R.D. 2003. Den molekylære motorværktøjskasse til intracellulær transport. Cell, 112: 467- 480.



Endnu ingen kommentarer