
Nuværende atommodelkarakteristika, postulater og indflydelsesrige forskere

Det nuværende atommodel er den, der er baseret på kvantemekanik, især på Schrödinger-ligningen, på Pauli-eksklusionsprincippet og en egenskab ved elektronen kaldet spin eller spin.
Det er den mest accepterede og anvendte model i undersøgelsen af strukturen af atomer, molekyler og den kemiske reaktivitet af grundstoffer på grund af præcisionen af dens forudsigelser og dens relative enkelhed..

Denne model er udviklingen af flere tidligere atommodeller, såsom Rutherford-modellen og Bohr-Sommerfeld-modellen, der betragtes som klassiske eller semi-klassiske modeller..
I øjeblikket er der teoretisk mere komplette modeller end Schrödingers kvantemekaniske model, såsom Dirac-Jordan-modellen, der inkorporerer speciel relativitet og er baseret på Dirac-bølgeligning. I denne ligning vises spin, egenskaberne ved elektroner nævnt i starten, naturligt.
Der er også modeller baseret på kvantefeltsteori, anvendt i højenergifysik. Disse modeller er fremragende til at forudsige skabelse og udslettelse af grundlæggende partikler, målet for dette felt af fysik..
Det er værd at nævne, at de mest sofistikerede teorier konvergerer til de samme resultater som Schrödinger-ligningen, især for lette atomer..
Artikelindeks
- 1 Karakteristika for den nuværende atommodel
- 1.1 Bølge - partikel dualitet
- 1.2 Atomets størrelse
- 2 Postulater af den nuværende atommodel
- 3 Forskere, der påvirker den nuværende atommodel
- 4 Artikler af interesse
- 5 Referencer
Karakteristika for den nuværende atommodel
I det nuværende syn på atomet, baseret på ikke-relativistisk kvantemekanik, passer begrebet elektroniske baner i stil med planetariske systemer ikke.
Imidlertid er det mest udbredte billede af atomet stadig af en positiv central kerne og et par punkter med negativ elektrisk ladning (elektroner), der roterer i perfekt definerede kredsløb omkring den centrale kerne. Men på trods af sine rødder svarer det ikke længere til den nuværende atommodel.
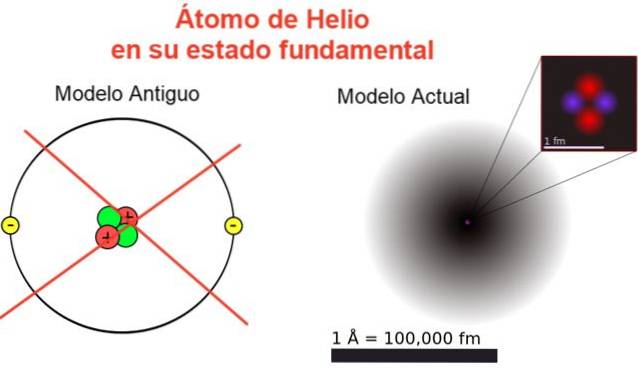
Figur 2 viser det gamle billede og det aktuelle billede af et heliumatom i dets laveste energitilstand (niveau n = 1 og l = 0).
Det klassiske billede er nyttigt for at se, at kernen indeholder to protoner og to neutroner. For at garantere atomets neutralitet er der to elektroner, der optager det samme energiniveau.
Resten er et billede langt fra virkeligheden, da kernens skala ikke engang svarer til atomets: kernen er 1/100000 gange atomets størrelse, men det er her atommassen er koncentreret.
Bølge - partikel dualitet
Klassisk mekanik fastslår, at hver materialepartikel har en tilknyttet bølge, kaldet bølgefunktion. Dette er den berømte bølge-partikel dualitet af Louis De Broglie.
I den nuværende atommodel er elektronens opførsel på atomskalaen fremtrædende bølgelignende, mens den på det makroskopiske niveau, ligesom elektronerne, der bevæger sig i katodestrålerørene i gamle fjernsynsapparater, dominerer den korpuskulære opførsel..
På den anden side sker der med fotoner det modsatte, i de fleste optiske fænomener (på makroskopisk niveau) har de en grundlæggende bølgefunktion. Og når de interagerer med atomer af stof, har de partikeladfærd.
På grund af dette er elektronerne omkring kernen spredt i kaldte områder atomorbitaler, hvis form og omfang afhænger af elektronernes energiniveau og vinkelmomentet.
Både energien og vinkelmomentet af elektronen omkring kernen har visse tilladte værdier, derfor siges de at være kvantiseret.
Schrödinger-bølgeligning forudsiger hvilke værdier af energi og vinkelmoment, der er tilladt, samt bølgefunktionen forbundet med hvert energiniveau og momentum..
Den matematiske firkant af bølgefunktionen bestemmer orbitalerne, det vil sige de områder omkring kernen, hvor elektroner kan findes med større sandsynlighed.
Atomets størrelse
For at have et målestokbillede af den nuværende atommodel, lad os forestille os, at et atom har en diameter som en fodboldbane. Kernen ville være som en myre i midten af marken, men forbløffende med 99,9% af atommassen.
På den anden side ville elektronerne være som spøgelsesagtige spillere spredt over hele feltet med større sandsynlighed for at blive fundet på midtbanen..
Der er et par justeringer eller tilladte måder at besætte marken på, som afhænger af spillernes energi (elektronerne) og mængden af "spin" eller spin rundt i midten..
Postulater af den nuværende atommodel
1. - Elektronen er kendetegnet ved sin masse m, ved sin spin s og fordi det er partiklen, der bærer en elementær negativ ladning (-e).
2.- Elektroner har dobbelt adfærd, af samtidig bølgepartikel, men afhængigt af deres energi og fænomenets størrelse kan den ene være mere overvældende end den anden..
3.- Elektronerne omgiver den positive atomkerne på en sådan måde, at de garanterer atomets elektriske neutralitet. Derfor er antallet af elektroner lig med antallet af protoner; Dette er Atom nummer, hvilket giver de grundlæggende kemiske og fysiske egenskaber.
4.- Samspillet mellem elektroner og kerne er modelleret af potentialet V (r) elektrostatisk Coulomb, hvortil den potentielle energiudtryk er inkorporeret i Hamilton-operatøren.
5.- Den kinetiske energiudtryk i Hamilton-operatøren er en operator, der er konstrueret ud fra den lineære momentumoperator, idet den er den samme:
s = - i ħ ∂ / ∂r
Hvor ħ er Plancks konstant divideret med 2π.
6. - Hamilton-operatøren H = (p⋅p)/ 2m - e V (r) virker på elektronbølgefunktionen Ψ (r).
7. - Da de stationære løsninger til den elektroniske bølgefunktion søges, anvendes den tidsuafhængige Schrödinger-ligning:
H Ψ (r) = E Ψ (r)
Hvor E repræsenterer elektronens samlede energi.
8.- I atomer med flere elektroner tages der ikke hensyn til interaktionen mellem dem.
9.- Når det kommer til atoner på mange elektroner, er orbitalerne i de yderste elektroner modelleret af potentialet i kernen, der er beskyttet af de inderste elektroner, som er kendt som Debye-potentiale..
10. - Ligning (7) har en løsning til nogle diskrete energiværdier, så den berømte planck quanta, vises naturligt fra løsningerne i Schrödinger-ligningen.
11.- For hver diskret værdi af E er der en bølgefunktion. Men nogle løsninger er degenererede afhængigt af værdien af vinkelmomentet L.
12.- Bølgefunktionen er et produkt af en radial funktion, den azimutale funktion og den polære funktion.
13.- Denne bølgefunktion bestemmer de områder, der er tilladt for elektronen. Kvadratet for bølgefunktionen er sandsynlighedstæthed at finde elektronen i en bestemt position set fra centrum af atomkernen.
14. - Spinnet vises ikke i Schrödinger-ligningen, men det er indarbejdet i atommodellen gennem Pauli-princippet:
Elektronen er en fermion med to mulige spin-tilstande + ½ og -½.
Så den samme tilstand, der er karakteriseret ved kvantetallene n, l, m i Schrödinger-ligningen, kan optages af højst 2 elektroner med modsatte spins. På denne måde bliver centrifugeringen det fjerde kvantetal.
Indflydelsesrige forskere i den nuværende atommodel
Det virker utroligt, men de fleste fysikere, der bidrog til den nuværende atommodel, vises på det samme billede. De mødtes på de berømte konferencer sponsoreret af Ernest Solvay, en kemiker og industriist af belgisk oprindelse, der blev berømt i videnskabens verden.
De begyndte at blive afholdt i 1911 og samlet de største forskere i øjeblikket, blandt dem var praktisk talt alle dem, der gav deres bidrag til den nuværende atommodel.
Den mest berømte af disse konferencer blev afholdt i Bruxelles i 1927, og dette historiske fotografi blev taget der:


- Peter afsked
- Irving langmuir
- Martin Knudsen
- Auguste Piccard
- Max plank
- William Lawrence Bragg
- Emile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Edouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max født
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Brillouin
- Niels Bohr
- Owen williams richardson
Artikler af interesse
Schrödingers atommodel.
Atomic de Broglie model.
Chadwick Atomic Model.
Heisenberg atommodel.
Perrins atommodel.
Thomsons atommodel.
Dalton atommodel.
Dirac Jordan atommodel.
Atomisk model af Democritus.
Atomisk model af Leucippus.
Bohr atommodel.
Referencer
- Alonso - Finn. Kvante- og statistiske fundamenter. Addison Wesley.
- Bauer, W. 2011. Fysik til ingeniørvidenskab. Bind 1. Mc Graw Hill.
- Eisberg og Resnick. Kvantefysik. Limusa - Wiley.
- Wikipedia. Atomteori. Gendannet fra: es.wikipedia.com
- Zapata F. Kvantemechanomodel af atomet. Gendannet fra: lifeder.com



Endnu ingen kommentarer