
Heisenberg atommodel

Hvad er Heisenbergs atommodel?
Det Heisenberg atommodel (1927) introducerer usikkerhedsprincippet i elektronorbitalerne omkring atomkernen. Den fremtrædende tyske fysiker lagde grundlaget for kvantemekanik for at estimere opførelsen af de subatomære partikler, der udgør et atom.
Werner Heisenbergs usikkerhedsprincip indikerer, at det ikke er muligt med sikkerhed at kende en elektrons position og det lineære momentum på samme tid. Det samme princip gælder for variablerne tid og energi; det vil sige, hvis vi har en anelse om elektronens position, kender vi ikke elektronens lineære momentum og omvendt.
Kort sagt er det ikke muligt at forudsige værdien af begge variabler samtidigt. Det foregående betyder ikke, at nogen af de ovennævnte mængder ikke kan kendes nøjagtigt. Så længe det er separat, er der ingen hindring for at opnå renteværdien.
Usikkerhed opstår imidlertid, når det gælder at kende samtidigt to konjugerede størrelser, såsom position og lineært momentum, og tid sammen med energi..
Dette princip opstår på grund af en strengt teoretisk begrundelse, som den eneste bæredygtige forklaring, der giver grund til videnskabelige observationer.
Karakteristik af Heisenberg atommodel

I marts 1927 offentliggjorde Heisenberg sit arbejde Om det perceptuelle indhold af kinematik og kvanteteoretisk mekanik, hvor du detaljerede usikkerheds- eller ubestemmelsesprincippet.
Dette princip, der er grundlæggende i den atommodel, der er foreslået af Heisenberg, er kendetegnet ved følgende:
- Usikkerhedsprincippet opstår som en forklaring, der supplerer de nye atomteorier om elektroners opførsel. På trods af brug af måleinstrumenter med høj præcision og følsomhed er ubestemmelighed stadig til stede i enhver eksperimentel test.
- På grund af usikkerhedsprincippet, når du analyserer to relaterede variabler, hvis du har en nøjagtig viden om en af disse, vil usikkerheden om værdien af den anden variabel være større og større..
- Momentet og placeringen af en elektron eller anden subatomær partikel kan ikke måles på samme tid.
- Forholdet mellem begge variabler er givet ved en ulighed. Ifølge Heisenberg er produktet af variationerne i det lineære momentum og partikelens position altid større end kvotienten mellem plankkonstanten (6.62606957 (29) × 10 -3. 4 Jules x sekunder) og 4π, som beskrevet i følgende matematiske udtryk:

Legenden, der svarer til dette udtryk, er følgende:
∆p: det lineære øjebliks ubestemmelighed.
∆x: ubestemmelighed af position.
h: Planken er konstant.
π: tal pi 3.14.
- I lyset af ovenstående har usikkerhedsproduktet som en nedre grænse forholdet h / 4π, som er en konstant værdi. Derfor, hvis en af størrelserne har en tendens til nul, skal den anden øges i samme forhold.
- Dette forhold gælder for alle par af konjugerede kanoniske størrelser. For eksempel: Heisenbergs usikkerhedsprincip gælder perfekt for energitidsparet, som beskrevet nedenfor:
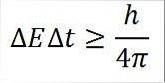
I dette udtryk:
∆E: ubestemmelighed af energi.
∆t: tidsbestemmelse.
h: Planken er konstant.
π: tal pi 3,14.
- Af denne model følger det, at absolut kausal determinisme i konjugerede kanoniske variabler er umulig, da man for at etablere dette forhold skal have viden om de indledende værdier for undersøgelsesvariablerne.
- Derfor er Heisenberg-modellen baseret på sandsynlighedsformuleringer på grund af den tilfældighed, der findes mellem variablerne på subatomære niveauer..
Eksperimentelle tests
Usikkerhedsprincippet i Heisenberg fremstår som den eneste mulige forklaring på de eksperimentelle tests, der fandt sted i de første tre årtier i det 21. århundrede..
Inden Heisenberg erklærede usikkerhedsprincippet, foreslog de gældende forskrifter på det tidspunkt, at variablerne lineær momentum, position, vinkelmoment, tid, energi, blandt andet for subatomære partikler blev defineret operationelt.
Dette betød, at de blev behandlet som om de var klassisk fysik; dvs. en startværdi blev målt, og den endelige værdi blev estimeret i henhold til den forudbestemte procedure.
Dette implicerede at definere et referencesystem til målinger, måleinstrumentet og måden at bruge instrumentet i overensstemmelse med den videnskabelige metode..
Følgelig måtte variablerne beskrevet af subatomære partikler opføre sig på en deterministisk måde. Det vil sige, at dets adfærd skulle forudsiges nøjagtigt og præcist..
Hver gang en test af denne art blev udført, var det imidlertid umuligt at opnå den teoretisk estimerede værdi i målingen..
Målingerne blev fordrejet på grund af eksperimentets naturlige forhold, og det opnåede resultat var ikke nyttigt til at berige atomteorien.
Eksempel
For eksempel: hvis det drejer sig om at måle hastigheden og placeringen af en elektron, skal opsætningen af eksperimentet overveje kollisionen mellem en lysfoton og elektronen.
Denne kollision inducerer en variation i hastigheden og den indre position af elektronet, hvormed målemålet ændres af de eksperimentelle forhold..
Derfor tilskynder forskeren forekomsten af en uundgåelig eksperimentel fejl på trods af nøjagtigheden og præcisionen af de anvendte instrumenter..
Kvantemekanik undtagen klassisk mekanik
Ud over ovenstående hedder Heisenbergs ubestemmelsesprincip, at kvantemekanik pr. Definition fungerer forskelligt fra klassisk mekanik.
Derfor antages det, at præcis viden om målinger på det subatomære niveau er begrænset af den fine linje, der adskiller klassisk og kvantemekanik..
Begrænsninger af Heisenberg-modellen
På trods af at forklare ubestemmelsen af subatomære partikler og fastslå forskellene mellem klassisk og kvantemekanik, opretter Heisenbergs atommodel ikke en eneste ligning til at forklare tilfældigheden af denne type fænomener..
Desuden indebærer det faktum, at forholdet er etableret gennem en ulighed, at rækkevidden af muligheder for produktet af to konjugerede kanoniske variabler er ubestemt. Derfor er usikkerheden forbundet med subatomære processer betydelig..
Artikler af interesse
Schrödingers atommodel.
Atomic de Broglie model.
Chadwick Atomic Model.
Perrins atommodel.
Thomsons atommodel.
Dalton atommodel.
Dirac Jordan atommodel.
Atomisk model af Democritus.
Atomisk model af Leucippus.
Bohr atommodel.
Sommerfeld atommodel.
Nuværende atommodel.
Referencer
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Gendannet fra: britannica.com
- Heisenberg Usikkerhedsprincippet (s.f.). Gendannet fra: hiru.eus
- García, J. (2012). Heisenbergs usikkerhedsprincip. Gendannet fra: hiberus.com
- Atomic modeller (s.f.). National Autonomous University of Mexico. Mexico DF, Mexico. Gendannet fra: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.) Gendannet fra: the-history-of-the-atom.wikispaces.com
- Wikipedia, The Free Encyclopedia (2018). Planken er konstant. Gendannet fra: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2018). Heisenbergs ubestemmelighed. Gendannet fra: es.wikipedia.org



Endnu ingen kommentarer