
Carnot-maskinformler, hvordan det fungerer og applikationer

Det carnot-maskine det er en ideel cyklisk model, hvor varme bruges til at udføre arbejde. Systemet kan forstås som et stempel, der bevæger sig inde i en cylinder, der komprimerer en gas. Den cyklus, der udøves, er den af Carnot, underkendt af termodynamikens far, den franske fysiker og ingeniør Nicolas Léonard Sadi Carnot..
Carnot erklærede denne cyklus i det tidlige nittende århundrede. Maskinen udsættes for fire tilstandsvariationer, skiftevis betingelser såsom temperatur og konstant tryk, hvor en variation af volumenet fremgår ved komprimering og udvidelse af gassen.
Artikelindeks
- 1 Formler
- 1.1 Isoterm ekspansion (A → B)
- 1.2 Adiabatisk ekspansion (B → C)
- 1.3 Isoterm kompression (C → D)
- 1.4 Adiabatisk kompression (D → A)
- 2 Hvordan fungerer Carnot-maskinen?
- 3 applikationer
- 4 Referencer
Formler
Ifølge Carnot er det muligt at maksimere den opnåede ydeevne, hvis den ideelle maskine udsættes for variationer i temperatur og tryk.
Carnot-cyklussen skal analyseres separat i hver af sine fire faser: isoterm ekspansion, adiabatisk ekspansion, isoterm kompression og adiabatisk kompression..
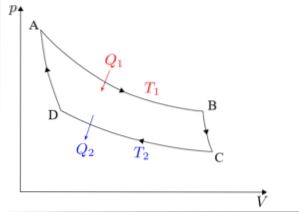
Formlerne, der er knyttet til hver af de faser af cyklussen, der udføres i Carnots maskine, vil blive beskrevet nedenfor..
Isoterm ekspansion (A → B)
Lokalerne i denne fase er følgende:
- Gasvolumen: går fra minimumsvolumen til medium volumen.
- Maskintemperatur: konstant temperatur T1, høj værdi (T1> T2).
- Maskintryk: falder fra P1 til P2.
Den isotermiske proces indebærer, at temperaturen T1 ikke varierer i løbet af denne fase. Varmeoverførsel inducerer gasudvidelse, som inducerer bevægelse på stemplet og producerer mekanisk arbejde.
Når gassen udvides, har den en tendens til at køle af. Imidlertid absorberer den varmen fra temperaturkilden, og under dens udvidelse opretholder den den konstante temperatur..
Da temperaturen forbliver konstant under denne proces, ændres den interne energi i gassen ikke, og al den varme, der absorberes af gassen, omdannes effektivt til arbejde. A) Ja:
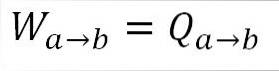
For sin del er det i slutningen af denne fase af cyklussen også muligt at opnå trykværdien ved hjælp af den ideelle gasligning. Således har vi følgende:
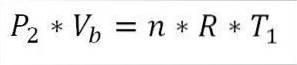
I dette udtryk:
Pto: Tryk i slutningen af fasen.
Vb: Volumen ved punkt b.
n: Antal mol gas.
A: Universal konstant af ideelle gasser. R = 0,082 (atm * liter) / (mol * K).
T1: Indledende absolut temperatur, grader Kelvin.
Adiabatisk ekspansion (B → C)
I løbet af denne fase af processen finder gasudvidelse sted uden behov for at udveksle varme. Lokalerne er således beskrevet nedenfor:
- Gasvolumen: går fra medium volumen til maksimal volumen.
- Maskintemperatur: falder fra T1 til T2.
- Maskintryk: konstant tryk P2.
Den adiabatiske proces indebærer, at trykket P2 ikke varierer i løbet af denne fase. Temperaturen falder, og gassen fortsætter med at ekspandere, indtil den når sit maksimale volumen; det vil sige, at stemplet når stoppet.
I dette tilfælde kommer det udførte arbejde fra den interne energi i gassen, og dens værdi er negativ, fordi energien falder under denne proces..
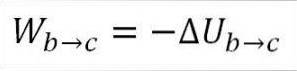
Forudsat at det er en ideel gas, antager teorien, at gasmolekyler kun har kinetisk energi. Ifølge principperne for termodynamik kan dette udledes af følgende formel:
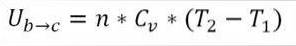
I denne formel:
∆Ub → c: Variation af intern energi af den ideelle gas mellem punkt b og c.
n: Antal mol gas.
Cv: Molær varmekapacitet for gas.
T1: Indledende absolut temperatur, grader Kelvin.
T2: Absolut sluttemperatur, grader Kelvin.
Isoterm kompression (C → D)
I denne fase begynder kompressionen af gassen; det vil sige at stemplet bevæger sig ind i cylinderen, hvormed gassen kontraherer sit volumen.
Betingelserne i denne fase af processen er beskrevet nedenfor:
- Gasvolumen: går fra maksimal volumen til mellemvolumen.
- Maskintemperatur: konstant temperatur T2, reduceret værdi (T2 < T1).
- Maskintryk: stiger fra P2 til P1.
Her stiger trykket på gassen, så den begynder at komprimere. Imidlertid forbliver temperaturen konstant, og derfor er variationen i intern energi i gassen nul.
Analogt med isotermisk ekspansion svarer det udførte arbejde til varmen i systemet. A) Ja:
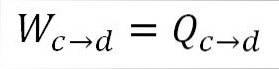
Det er også muligt at finde trykket på dette tidspunkt ved hjælp af den ideelle gasligning.
Adiabatisk kompression (D → A)
Det er den sidste fase af processen, hvor systemet vender tilbage til sine oprindelige forhold. Til dette overvejes følgende betingelser:
- Gasvolumen: går fra et mellemvolumen til et minimalt volumen.
- Maskintemperatur: stiger fra T2 til T1.
- Maskintryk: konstant tryk P1.
Varmekilden, der er inkorporeret i systemet i den forrige fase, fjernes, så den ideelle gas hæver temperaturen, så længe trykket forbliver konstant..
Gassen vender tilbage til de indledende temperaturforhold (T1) og til dens volumen (minimum). Endnu en gang kommer det udførte arbejde fra gasens interne energi, så du skal:
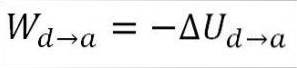
I lighed med adiabatisk ekspansion er det muligt at opnå variationen i gasenergien ved hjælp af følgende matematiske udtryk:
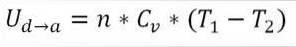
Hvordan fungerer Carnot-maskinen?
Carnot-motoren fungerer som en motor, hvor ydelsen maksimeres ved forskellige isotermiske og adiabatiske processer, skiftevis ekspansions- og kompressionsfaserne for en ideel gas..
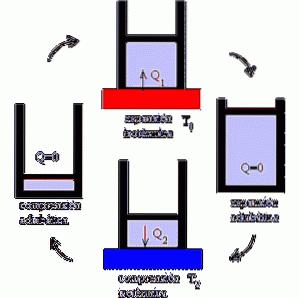
Mekanismen kan forstås som en ideel enhed, der udfører arbejde, der udsættes for varme variationer, givet eksistensen af to temperaturkilder.
I det første fokus udsættes systemet for en temperatur T1. Det er en høj temperatur, der lægger stress på systemet og får gassen til at ekspandere..
Til gengæld oversættes dette til udførelsen af et mekanisk arbejde, der tillader mobilisering af stemplet ud af cylinderen, og hvis stop kun er muligt gennem adiabatisk ekspansion.
Derefter kommer det andet fokus, hvor systemet udsættes for en temperatur T2, der er lavere end T1; det vil sige, at mekanismen udsættes for afkøling.
Dette inducerer ekstraktion af varme og knusning af gassen, som når sin oprindelige volumen efter adiabatisk kompression..
Ansøgninger
Carnot-maskinen er blevet brugt i vid udstrækning takket være dens bidrag til forståelsen af de vigtigste aspekter af termodynamik.
Denne model giver en klar forståelse af variationerne af ideelle gasser, der udsættes for ændringer i temperatur og tryk, hvilket gør det til en referencemetode, når man designer ægte motorer..
Referencer
- Carnot Heat Engine Cycle og 2. lov (s.f.). Gendannet fra: nptel.ac.in
- Castellano, G. (2018). Carnot maskine. Gendannet fra: famaf.unc.edu.ar
- Carnot cyklus (s.f.) Ecured. Havana Cuba. Gendannet fra: ecured.cu
- Carnot-cyklussen (s.f.). Gendannet fra: sc.ehu.es
- Fowler, M. (s.f.). Varmemotorer: Carnot-cyklussen. Gendannet fra: galileo.phys.virginia.edu
- Wikipedia, The Free Encyclopedia (2016). Carnot maskine. Gendannet fra: es.wikipedia.org



Endnu ingen kommentarer