
Calciumnitrat (Ca (NO3) 2) struktur, egenskaber og anvendelser

Det calciumnitrat er et tertiært uorganisk salt, hvis kemiske formel er Ca (NO3)to. Fra dets formel er det kendt, at dets faste stof er sammensat af Ca-ionerto+ og nej3- i forholdet 1: 2. Derfor er det en forbindelse af rent ionisk natur..
En af dens egenskaber er dens oxiderende karakter på grund af nitratanionen. Det er ikke brændbart, det vil sige, det brænder ikke ved høje temperaturer. Da det ikke er brændbart, repræsenterer det et sikkert solidt at håndtere uden meget pleje; dog kan det fremskynde antændelsen af brændbare materialer.

Dens udseende består af et granulært fast stof, der har en hvid eller lysegrå farve (øverste billede). Det kan være vandfrit eller tetrahydrat, Ca (NO3)to4HtoO. Det er meget opløseligt i vand, methanol og acetone.
Calciumnitrat har været meget brugt som gødning, da det bevæger sig let i fugtig jord og absorberes hurtigt af planterødderne. Tilbyder to vigtige elementer til plantens ernæring og vækst: nitrogen og calcium.
Kvælstof er et af de tre væsentlige elementer til udvikling af planter (N, P og K), det er vigtigt i syntesen af proteiner. I mellemtiden er calcium nødvendigt for at opretholde strukturen i plantecellevæggen. Af denne grund Ca (NO3)to meget går til haver.
På den anden side har dette salt toksiske virkninger, især ved direkte kontakt med huden og øjnene samt ved at indånde dets støv. Derudover kan den nedbrydes ved opvarmning.
Artikelindeks
- 1 Struktur af calciumnitrat
- 2 Fysiske og kemiske egenskaber
- 2.1 Kemiske navne
- 2.2 Molekylær formel
- 2.3 Molekylvægt
- 2.4 Fysisk udseende
- 2.5 Kogepunkt
- 2.6 Smeltepunkt
- 2.7 Opløselighed i vand
- 2.8 Opløselighed i organiske opløsningsmidler
- 2.9 Surhed (pKa)
- 2.10 Tæthed
- 2.11 Nedbrydning
- 2.12 Reaktiv profil
- 3 anvendelser
- 3.1 Landbrug
- 3.2 Beton
- 3.3 Rensning af spildevand eller spildevand
- 3.4 Fremstilling af kolde kompresser
- 3.5 Latexkoagulation
- 3.6 Varmeoverførsel og opbevaring
- 4 Ansøgningsformer
- 5 Referencer
Struktur af calciumnitrat
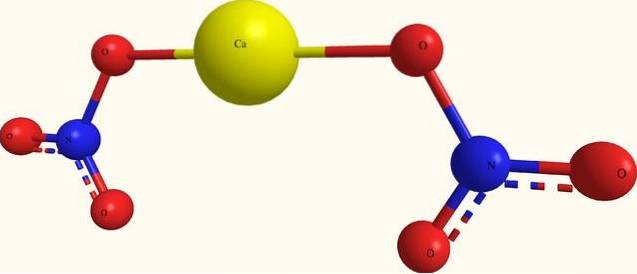
Det øverste billede viser strukturen af Ca (NO3)to i en model af kugler og stænger. Her er der imidlertid en fejl: der antages eksistensen af kovalente Ca-O-bindinger, som modsiger deres ioniske karakter. Afklaring af dette er virkelig interaktionerne af den elektrostatiske type.
Kationen Cato+ omgiver sig med to INGEN anioner3- i henhold til dets proportioner på glasset. Derfor dominerer nitrogen i form af nitrat i den krystallinske struktur..
Ionerne er grupperet på en sådan måde, at de etablerer en konfiguration, hvis mindste udtryk er enhedscellen; som for det vandfri salt er kubisk. Det vil sige, fra terninger, der indeholder forholdet 1: 2 for disse ioner, gengives hele krystallen.
På den anden side er tetrahydratsaltet, Ca (NO3)to4HtoEller den har fire vandmolekyler for hvert sæt NO3- ACto+ IKKE3-. Dette ændrer krystalstrukturen og deformerer den til en monoklinisk enhedscelle..
Derfor forventes krystallerne for både de vandfri og tetrahydrasalte at være forskellige; forskelle, der kan bestemmes i deres fysiske egenskaber, for eksempel smeltepunkter.
Fysiske og kemiske egenskaber
Kemiske navne
-Calciumnitrat
-Calcium dinitrat
-Nitrocalcite
-Norsk saltpeter og limesaltpetro.
Molekylær formel
Tud3)to eller CaNtoELLER6
Molekylær vægt
Vandfri 164,088 g / mol og tetrahydrat 236,15 g / mol. Bemærk vandets indvirkning på molekylvægten, og det kan ikke overses, når det vejes..
Fysisk fremtoning
Hvidt eller lysegråt fast stof eller granulat. Kubiske hvide krystaller eller delikatiserende granulater; det vil sige, de absorberer fugt til det punkt, at de opløses som et resultat af deres høje opløselighed.
Kogepunkt
Den vandfrie form nedbrydes ved opvarmning til en temperatur, der forhindrer bestemmelsen af dens kogepunkt; mens saltets tetrahydratform har et kogepunkt på 132 ° C (270ºF, 405K).
Smeltepunkt
-Vandfri form: 561 ° C til 760 mmHg (1042 ° F, 834 K).
-Tetrahydratform: 42,7 ° C (109 ° F, 316 K).
Dette viser, hvordan vandmolekyler interfererer med elektrostatiske interaktioner mellem Cato+ og nej3- inde i krystaller og følgelig smelter det faste stof ved en meget lavere temperatur.
Vandopløselighed
-Vandfri form: 1212 g / L ved 20 ºC.
-Tetrahydratform: 1290 g / L ved 20 ºC.
Vandet i krystallerne øger næppe saltets opløselighed.
Opløselighed i organiske opløsningsmidler
-I ethanol 51,42 g / 100 g ved 20 ° C.
-I methanol 134 g / 100 g ved 10 ° C.
-I acetone, 168 g / 100 g ved 20 ° C.
Surhed (pKa)
6.0
Massefylde
2,5 g / cm3 ved 25 ºC (tetrahydrat).
Nedbrydning
Når calciumnitrat opvarmes til glød, nedbrydes det til calciumoxid, nitrogenoxid og ilt..
Reaktiv profil
Det er et stærkt oxiderende middel, men det er ikke brændbart. Fremskynder antændelsen af brændbare materialer. Opdelingen af calciumnitrat i fine partikler letter dets eksplosion, når forbindelsen udsættes for langvarig brand.
Blandinger med alkylestere bliver eksplosive ved at opstille alkylnitratestere. Kombinationen af calciumnitrat med fosfor, tin (II) chlorid eller andet reduktionsmiddel kan reagere eksplosivt.
Ansøgninger
landbrug
Det bruges i afgrøder som kilde til kvælstof og calcium. Calciumnitrat er meget opløseligt i vand og absorberes let af planterødderne. Derudover forsyrer den ikke jord, fordi dens ioner ikke kan hydrolyseres væsentligt..
Blanding med gødning indeholdende fosfor eller sulfat bør undgås for at undgå dannelse af uopløselige salte. På grund af dets hygroskopicitet skal den opbevares i et tørt og køligt miljø.
Dens anvendelse har en fordel i forhold til brugen af ammoniumnitrat som gødning. Selv om denne sidste forbindelse bidrager med kvælstof til planter, interfererer den med calciumabsorptionen, hvilket kan føre til en calciummangel i planter..
Calcium bidrager til vedligeholdelsen af cellevægsstrukturen af planter. I nærværelse af en calciummangel viser det voksende væv af planter, såsom rodspidser, unge blade og skudspidser ofte forvrænget vækst..
Nedsat ammoniak
Calciumnitrat reducerer ophobningen af flygtige fedtsyrer og phenolforbindelser, fytotoksiske, der akkumuleres på grund af nedbrydning af sojabønneafgrøderester.
Derudover er der en tendens til, at calciumnitrat nedsætter ammoniumkoncentrationen i jorden, hvilket øger hydrogenbufferkapaciteten..
Beton
Calciumnitrat bruges til at reducere betonens hærdningstid. Dette produceres ved dannelsen af calciumhydroxid, måske gennem en dobbelt fortrængningsreaktion..
Derudover inducerer calciumnitrat dannelsen af jernhydroxidforbindelsen, hvis beskyttende virkning på beton reducerer dets korrosion. Det til stede jern, der er til stede, kan reagere med de grundlæggende komponenter i beton, såsom calciumhydroxid selv..
Calciumnitrat nedsætter hærdningstiden samt betonens modstand, hvortil vulkanaske er tilsat. For at undersøge effekten af tilsætning af calciumnitrat til beton er der anvendt stigende koncentrationer af calciumnitrat mellem 2% og 10%..
Et større fald i hærdetid er observeret såvel som en stigning i betonstyrke, da koncentrationen af calciumnitrat steg op til 10%.
Spildevandsrensning eller spildevandsrensning
Calciumnitrat bruges til at reducere lugt fra spildevand ved at reducere dannelsen af hydrogensulfid. Derudover forbruges det organiske materiale, der genererer anaerobe forhold, hvilket gør det vanskeligt for mange biologiske arter at overleve..
Gør kolde kompresser
Calciumnitrattetrahydrat er en endoterm forbindelse, det vil sige det har evnen til at absorbere varme fra det omgivende miljø. Dette producerer en afkøling af de kroppe, der kommer i kontakt med beholderne, der indeholder det..
Kompresserne øger deres temperatur, og for at regenerere dem er det nok at placere dem i en fryser
Latex koagulation
Calciumnitrat anvendes i latexkoagulationsfasen. Det er en del af nedsænkningsopløsningen, og når den kommer i kontakt med opløsningen, der indeholder latex, bryder den sin stabilisering og forårsager dens koagulation..
Varmeoverførsel og opbevaring
Den binære blanding af smeltede nitratsalte, herunder calcium med andre nitrater, anvendes i stedet for termisk olie i solkraftværker til varmeoverførsel og opbevaring.
Ansøgningsformer
-Calciumnitrat påføres blandet med jorden i en koncentration på 1,59 kg pr. 30,48 mto, med tilstrækkelig vanding. Calciumnitrat opløses i vand, hvilket tillader dets absorption af plantens rødder. I hydroponiske afgrøder opløses det i voksende vand.
-Calciumnitrat bruges også i form af en spray til sprøjtning af blade og blomster, hvilket er en effektiv behandling til forebyggelse af rådnende tomatblomst, korkplet og æbleets bitre pit..
-En mængde calciumnitrat tilsættes til den betondannende blanding (cement, sand, sten og vand), og den virkning, som dens tilsætning har på betonens specifikke egenskaber, bestemmes; såsom indstilling af hastighed og styrke.
-Calciumnitrat tilsættes i en passende koncentration for at reducere lugt fra spildevand eller spildevand til et niveau, hvor lugt er acceptabel for mennesker.
Referencer
- Bonnie L. Grant. (2019). Kalciumnitratgødning - Hvad gør calciumnitrat for planter. Gendannet fra: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. og Vyn, T.J. (1990). Anvendelsen af calciumnitrat til at reducere fytotoksinakkumulering under nedbrydning af kropsrester. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. og Hassan, I.O. (2011). Virkning af tilsætning af calciumnitrat på selektive egenskaber af beton, der indeholder vulkansk aske. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Calciumnitrat. Gendannet fra: en.wikipedia.org
- Shiqi Dong & col. (2018). Hæmning af stålkorrosion med calciumnitrat i halogenberiget færdiggørelsesfluidumiljøer. npj Materialer Nedbrydningsvolumen 2, Artikelnummer: 32.
- Emaginationz Technologies. (2019). Specifikationer for calciumnitrat. Gendannet fra: direct2farmer.com
- PubChem. (2019). Calciumnitrat. Gendannet fra: pubchem.ncbi.nlm.nih.gov


Endnu ingen kommentarer