
Calciumperoxid (CaO2) egenskaber, risici og anvendelser
Det calciumperoxid, også kendt som calciumdioxid, det er en kemisk forbindelse med formlen CaOto. Det sker med vekselvirkningen af opløsningen af et salt eller calciumhydroxid og natriumperoxid med efterfølgende krystallisation.
Calciumperoxid produceres ved udfældning af octahydratforbindelsen fra en vandig opløsning efterfulgt af dehydrering ved temperaturer over 100 ° C..
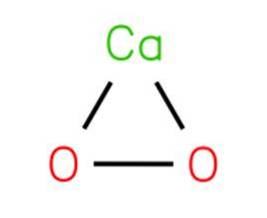
Calciumperoxid nedbrydes for at frigive ilt ved kontakt med hydratiseret materiale. CaOto er en af de mest temperaturstabile uorganiske peroxider og nedbrydes langsomt i fugtig luft.
En 1: 100 vandig suspension har en pH-værdi på ca. 12. Bortset fra dens stabile oxygenfrigivende kapacitet, CaOto Det har lignende funktioner i andre peroxider: blegning, desinfektion og deodorisering. Desuden er det bemærkelsesværdigt at bemærke, at CaOto det er respektfuldt for miljøet på grund af dets egenskaber. (Kingsfield Inc, 2011).
Artikelindeks
- 1 Fysiske og kemiske egenskaber af calciumperoxid
- 2 Reaktivitet og farer
- 3 anvendelser
- 3.1 Anvendelse til jordrensning
- 3.2 Andre anvendelser
- 3.3 Miljøgenopretning
- 3.4 Industriel anvendelse
- 4 Referencer
Fysiske og kemiske egenskaber af calciumperoxid
Calciumperoxid er et hvidt eller gulligt pulver uden karakteristisk aroma eller smag (National Center for Biotechnology Information., 2017).

CaOto den har en molekylvægt på 72,0768 g / mol og en densitet på 2,91 g / ml. Forbindelsen har et smeltepunkt på 200 ° C og nedbrydes over 355 ° C. Det er let opløseligt i vand og danner hydrogenperoxid. Den har en pKa på 12,5 (Royal Society of Chemistry, 2015).
Calciumperoxid er en eksplosionsfare, hvis det blandes med findelt organisk materiale. Forbindelsen er ikke brændbar i sig selv, men fremskynder snarere forbrændingen af brændbart materiale. Dette skyldes, at blandinger af brændbart materiale og peroxid kan antændes ved friktion eller kontakt med fugt..
Reaktivitet og farer
Selvom det er en relativt stabil forbindelse sammenlignet med andre peroxider, er calciumperoxid klassificeret som en eksplosiv forbindelse og et stærkt oxidationsmiddel..
Kontakt med calciumperoxid kan være stærkt irriterende og kan forbrænde hud og øjne. Eksponering kan irritere øjne, næse og hals.
Langvarig eksponering kan beskadige huden. Højere niveauer af calciumperoxid kan irritere lungerne og forårsage hoste eller åndenød..
Endnu højere eksponeringer kan medføre væskeophobning i lungerne (lungeødem), hvilket fører til døden (National Library of Medicine, 2015).
I tilfælde af kontakt med øjnene skal kontaktlinserne kontrolleres og fjernes. Vask derefter straks øjnene med rigeligt koldt vand i mindst 15 minutter..
I tilfælde af hudkontakt skal det berørte område skylles straks med rigeligt vand i mindst 15 minutter, mens forurenet tøj og sko fjernes. Dæk irriteret hud med et blødgørende middel. Vask tøj og sko inden genbrug. Hvis kontakten er svær, skal du vaske med en desinfektionsmiddel og dække den forurenede hud med en antibakteriel creme..
I tilfælde af indånding skal offeret flyttes til et køligt sted. Hvis man ikke trækker vejret, gives kunstig åndedræt.
Hvis forbindelsen indtages, fremkald opkastning, medmindre det er instrueret af medicinsk personale. Det tilrådes at drikke store mængder vand for at opnå fortynding af forbindelsen. Stramt tøj såsom en skjortekrave, bælte eller slips skal løsnes..
I alle tilfælde bør lægehjælp indhentes straks (Sikkerhedsdatablad Calciumperoxide, 2013).
Ansøgninger
Anvendelse til jordrensning
Af alle de måder, du kan bruge calciumperoxid på, er dets landbrugsanvendelse den mest udbredte. Det faktum, at calciumperoxid frigiver ilt, når det er i kontakt med vand, betyder, at det kan bruges som en måde at forynge forarmet jord på..
Normalt, efter intensivt landbrug eller når jorden er oversvømmet, går næringsstoffer og ilt tabt fra jorden, hvilket gør den steril..
I et sådant scenario skal forskellige kunstgødninger bruges til at tilføje mineraler og næringsstoffer til jorden ud over andre indgreb for at gøre den levedygtig igen. Calciumperoxid er afgørende for denne proces, da det bruges til at øge iltindholdet i jorden.
Andre anvendelser
Det faktum, at calciumperoxid kan frigive hydrogenperoxid, når det kombineres med syrer, betyder, at det kan bruges som blegemiddel..
Det bruges i vid udstrækning på denne måde i mange papirindustrier. Produktionen af hydrogenperoxid af denne forbindelse gør det også nyttigt til deodorisering og blegning af hårprodukter såvel som tekstiler..
Calciumperoxid har også et sted i sundhedsvæsenet, da det kan bruges som et antiseptisk middel..
Calciumperoxid anvendes til bagning som et hjælpemiddel til forarbejdning af brøddej. Forbindelsen nedbrydes til ilt, når den kommer i kontakt med vand. Dette oxiderer og styrker disulfid- og ikke-disulfid-tværbindingerne i gluten..
Genopretning af miljøet
Det faktum, at calciumperoxid kan fungere som iltkilde, betyder, at det er nyttigt i mange økologiske omgivelser..
For eksempel er der mange vandmasser, såsom søer og damme, der er blevet ustabile på grund af forurening og andre relaterede faktorer..
I et sådant scenario kan calciumperoxid også bruges til at forynge disse vandmasser. Det ilt, der frigøres ved reaktionen mellem vandet og forbindelsen, gendanner vandets iltindhold.
Industriel anvendelse
Rollen af calciumperoxid i produktionen af plast er afgørende for katalyseprocesserne og tværbindingen af de forskellige forbindelser, der anvendes til polymerisationen af plast for at gøre dem hårde. Calciumperoxid bruges også som en initiativtager til disse processer (Chuangjia Chemical Co, 2011).
Referencer
- KALCIUMPEROXID. (2016). Gendannet fra cameochemicals.noaa.gov.
- Calciumperoxid. (S.F.). Gendannet fra bakerpedia.com.
- Chuangjia Chemical Co. (2011). Calciumperoxid. Gendannet fra chinacjchem.com.
- EMBL-EBI. (2014, 28. juli). calciumperoxid. Gendannet fra ebi.ac.uk.
- Kingsfield Inc. (2011). Calciumperoxid-CALGRO ™. Gendannet fra kingsfieldinc.
- Sikkerhedsdatablad Calciumperoxid. (2013, 21. maj). Gendannet fra sciencelab.com.
- National Center for Biotechnology Information ... (2017, 11. marts). PubChem Compound Database; CID = 14779. Hentet fra PubChem.
- National Library of Medicine. (2015, 19. oktober). KALCIUMPEROXID. Gendannet detoxnet.
- Royal Society of Chemistry. (2015). Calciumdioxidandid. Gendannet fra chemspider.com.



Endnu ingen kommentarer