
Hvad er den eksterne elektronkonfiguration?

Det elektronisk konfiguration, Også kaldet elektronisk struktur, det er arrangementet af elektroner i energiniveauer omkring en atomkerne. Ifølge den gamle Bohr-atommodel optager elektroner forskellige niveauer i kredsløb omkring kernen, fra den første skal nærmest kernen, K, til den syvende skal, Q, som er længst væk fra kernen..
Med hensyn til en mere raffineret kvantemekanisk model er K-Q-skaller opdelt i et sæt orbitaler, som hver især kan optages af ikke mere end et par elektroner..
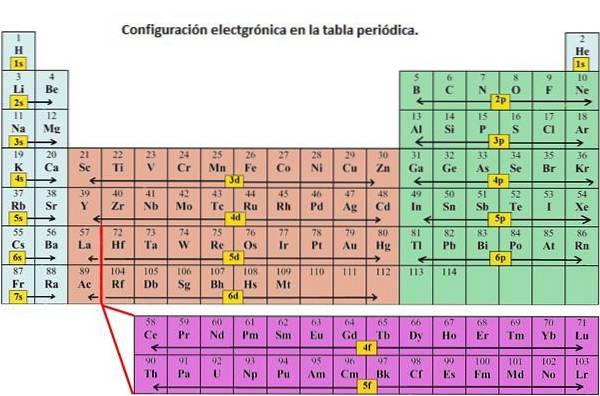
Almindeligvis anvendes elektronkonfigurationen til at beskrive et atoms orbitaler i dets jordtilstand, men det kan også bruges til at repræsentere et atom, der er ioniseret til en kation eller anion, hvilket kompenserer for tab eller gevinst af elektroner i deres respektive orbitaler. ..
Mange af grundstoffernes fysiske og kemiske egenskaber kan korreleres med deres unikke elektroniske konfigurationer. Valenselektroner, elektronerne i den yderste skal, er den afgørende faktor for elementets unikke kemi..
Grundlæggende om elektronkonfigurationer
Før man tildeler et atoms elektroner til orbitaler, bør man gøre sig bekendt med det grundlæggende i elektronkonfigurationer. Hvert element i det periodiske system består af atomer, der består af protoner, neutroner og elektroner..
Elektroner udviser en negativ ladning og findes omkring atomkernen i elektronens orbitaler defineret som det rumfang, hvori elektronen kan findes inden for 95% sandsynlighed..
De fire forskellige typer orbitaler (s, p, d og f) har forskellige former, og en orbital kan maksimalt indeholde to elektroner. P-, d- og f-orbitalerne har forskellige underniveauer, så de kan rumme flere elektroner.
Som angivet er elektronkonfigurationen for hvert element unik for dets position i det periodiske system. Energiniveauet bestemmes af perioden, og antallet af elektroner er angivet af elementets atomnummer.
Orbitaler på forskellige energiniveauer ligner hinanden, men optager forskellige områder i rummet..
1s orbital og 2s orbital har karakteristika for en s orbital (radiale noder, sfæriske volumen sandsynligheder, de kan kun indeholde to elektroner osv.). Men fordi de har forskellige energiniveauer, optager de forskellige rum omkring kernen. Hver orbital kan repræsenteres af specifikke blokke i det periodiske system..
Blok s er regionen med alkalimetaller inklusive helium (gruppe 1 og 2), blok d er overgangsmetalerne (gruppe 3 til 12), blok p er elementerne i hovedgruppen i gruppe 13 til 18, og f-blokken er lanthanid- og actinidserien.

Aufbau-princippet
Aufbau kommer fra det tyske ord "Aufbauen", som betyder "at bygge". I det væsentlige bygger vi ved at skrive elektronkonfigurationer elektronorbitaler, når vi bevæger os fra et atom til et andet..
Når vi skriver et atoms elektronkonfiguration, udfylder vi orbitalerne i stigende rækkefølge med atomnummer.
Aufbau-princippet stammer fra Pauli-udelukkelsesprincippet, der siger, at der ikke er to fermioner (fx elektroner) i et atom. De kan have det samme sæt kvantetal, så de er nødt til at "stable" ved højere energiniveauer.
Hvordan elektroner akkumuleres er et emne for elektronkonfigurationer (Aufbau Principle, 2015).
Stabile atomer har lige så mange elektroner som protoner i kernen. Elektroner samles omkring kernen i kvanteorbitaler efter fire grundlæggende regler kaldet Aufbau-princippet..
- Der er ikke to elektroner i atomet, der deler de samme fire kvantetal n, l, m og s.
- Elektroner optager orbitaler med det laveste energiniveau først.
- Elektronerne udfylder altid orbitalerne med det samme spin-nummer. Når orbitalerne er fulde, begynder det.
- Elektronerne udfylder orbitaler med summen af kvantetallene n og l. Orbitaler med lige værdier på (n + l) udfyldes først med de lavere n-værdier.
Den anden og fjerde regel er dybest set den samme. Et eksempel på regel fire ville være 2p og 3s orbitaler.
En 2p orbital er n = 2 og l = 2 og en 3s orbital er n = 3 og l = 1. (N + l) = 4 i begge tilfælde, men 2p orbital har den laveste energi eller laveste n-værdi og vil fyld før laget 3s.
Heldigvis kan Moeller-diagrammet vist i figur 2 bruges til at udfylde elektron. Grafen læses ved at køre diagonalerne fra 1s.
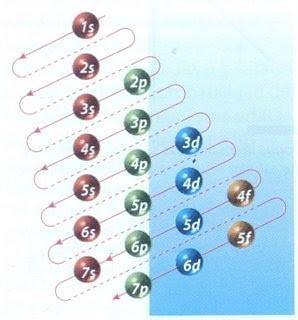
Figur 2 viser atomorbitalerne, og pilene følger vejen frem.
Nu hvor ordenes rækkefølge vides at være udfyldt, er det eneste tilbage at huske størrelsen på hver orbital.
S-orbitaler har 1 mulig værdi på ml at holde 2 elektroner
P-orbitaler har 3 mulige værdier på ml at holde 6 elektroner
D-orbitaler har 5 mulige værdier på ml at rumme 10 elektroner
F-orbitaler har 7 mulige værdier på ml at rumme 14 elektroner
Dette er alt, hvad der er nødvendigt for at bestemme den elektroniske konfiguration af et stabilt atom af et element..
Tag for eksempel elementet nitrogen. Kvælstof har syv protoner og derfor syv elektroner. Den første orbital, der skal udfyldes, er 1s-orbitalen.
En s orbital har to elektroner, så der er fem elektroner tilbage. Den næste orbital er 2s orbital og indeholder de næste to. De sidste tre elektroner vil gå til 2p-orbitalen, der kan rumme op til seks elektroner (Helmenstine, 2017).
Betydningen af ekstern elektronkonfiguration
Elektronkonfigurationer spiller en vigtig rolle i bestemmelsen af atommers egenskaber.
Alle atomer i den samme gruppe har den samme eksterne elektroniske konfiguration med undtagelse af atomnummeret n, hvorfor de har lignende kemiske egenskaber.
Nogle af de nøglefaktorer, der påvirker atomegenskaberne, inkluderer størrelsen på de største besatte orbitaler, energien i orbitalerne med højere energi, antallet af ledige orbitaler og antallet af elektroner i orbitalerne med højere energi..
De fleste atomare egenskaber kan relateres til graden af tiltrækning mellem de yderste elektroner til kernen og antallet af elektroner i den yderste elektronskal, antallet af valenselektroner.
Elektronerne i den ydre skal er dem, der kan danne kovalente kemiske bindinger, de er dem, der har evnen til at ionisere til at danne kationer eller anioner, og det er dem, der giver oxidationstilstanden til de kemiske grundstoffer.
De vil også bestemme atomradius. Når n bliver større, øges den atomare radius. Når et atom mister en elektron, vil der være en sammentrækning af atomradius på grund af faldet i negativ ladning omkring kernen..
Elektronerne i den ydre skal er dem, der tages i betragtning ved valensbindingsteorien, krystallinsk feltteori og molekylær orbitalteori for at opnå molekylernes egenskaber og hybridiseringerne af bindingerne..
Referencer
- Aufbau-princippet. (2015, 3. juni). Hentet fra chem.libretexts: chem.libretexts.org.
- Bozeman videnskab. (2013, udmattet 4). Elektronkonfiguration. Hentet fra youtube: youtube.com.
- Elektronkonfigurationer og atomernes egenskaber. (S.F.). Hentet fra oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7. september). Elektronisk konfiguration. Hentet fra britannica: britannica.com.
- Faizi, S. (2016, 12. juli). Elektroniske konfigurationer. Hentet fra chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7. marts). Aufbau-princippet - Elektronisk struktur og Aufbau-princippet. Hentet fra thoughtco: thoughtco.com.
- Khan, S. (2014, 8. juni). Valenselektroner og binding. Hentet fra khanacademy: khanacademy.org.



Endnu ingen kommentarer