
Hvad er fordampning?

Det fordampning er processen med at omdanne et kemisk stof fra en flydende eller fast tilstand til en gasformig eller damptilstand. Andre udtryk, der bruges til at beskrive den samme proces, er fordampning, destillation og sublimering..
Et stof kan ofte adskilles fra et andet ved fordampning og kan derefter udvindes ved dampkondensation..

Stoffet kan hurtigere fordampes ved enten at opvarme det for at øge dets damptryk eller ved at fjerne dampen ved hjælp af en inert gasstrøm eller en vakuumpumpe..
Opvarmningsprocedurer inkluderer fordampning af vand, kviksølv eller arsen-trichlorid for at adskille disse stoffer fra forstyrrende elementer..
Kemiske reaktioner bruges undertiden til at producere flygtige produkter som ved frigivelse af kuldioxid fra carbonater, ammoniak i Kjeldahl-metoden til bestemmelse af kvælstof og svovldioxid ved bestemmelse af svovl i stål.
Fordampningsmetoderne er generelt kendetegnet ved stor enkelhed og brugervenlighed, undtagen når der er brug for høje temperaturer eller materialer, der er meget modstandsdygtige over for korrosion (Louis Gordon, 2014).
Fordampning af damptryk
Ved du at vide, at kogetemperaturen på vand er 100 ° C, har du nogensinde spekuleret på, hvorfor regnvand fordamper??
Er det 100 ° C? Hvis ja, hvorfor bliver jeg ikke varm? Har du nogensinde spekuleret på, hvad der giver den karakteristiske aroma til alkohol, eddike, træ eller plast? (Damptryk, S.F.)
Ansvarlig for alt dette er en egenskab kendt som damptryk, hvilket er det tryk, der udøves af en damp i ligevægt med den faste eller flydende fase af det samme stof..
Også det delvise tryk af stoffet i atmosfæren på det faste stof eller væsken (Anne Marie Helmenstine, 2014).
Damptryk er et mål for materialets tendens til at skifte til gas- eller damptilstand, det vil sige et mål for stoffers flygtighed.
Efterhånden som damptrykket stiger, desto større er væskens eller faststofets evne til at fordampe og dermed mere flygtigt..
Damptryk vil stige med temperaturen. Temperaturen, ved hvilken damptrykket på overfladen af en væske svarer til det tryk, der udøves af miljøet, kaldes væskens kogepunkt (Encyclopædia Britannica, 2017).
Damptrykket afhænger af det opløste stof, der er opløst i opløsning (det er en kolligativ egenskab). På overfladen af opløsningen (luft-gas-grænseflade) har de mest overfladiske molekyler tendens til at fordampe, udveksle mellem faser og generere et damptryk..
Tilstedeværelsen af opløst stof mindsker antallet af opløsningsmiddelmolekyler ved grænsefladen og reducerer damptrykket..
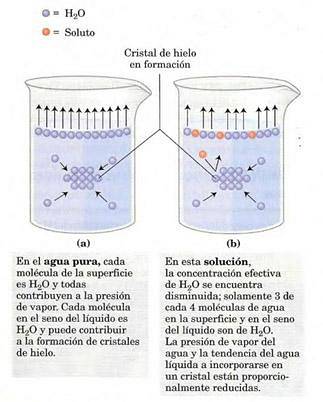
Ændringen i damptryk kan beregnes med Raoults lov for ikke-flygtige opløste stoffer, der er givet ved:
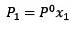
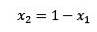
Hvor X2 er molfraktionen af opløsningsmidlet. Hvis vi multiplicerer begge sider af ligningen med P °, forbliver den:
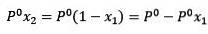
Udskiftning (1) i (3) er:
(4)
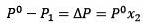
Dette er variationen i damptryk, når et opløst stof opløses (Jim Clark, 2017).
Gravimetrisk analyse
Gravimetrisk analyse er en klasse af laboratorieteknikker, der anvendes til at bestemme massen eller koncentrationen af et stof ved at måle en masseændring..
Det kemikalie, vi prøver at kvantificere, kaldes undertiden analytten. Vi kunne bruge gravimetrisk analyse til at besvare spørgsmål som:
- Hvad er koncentrationen af analytten i en opløsning?
- Hvor ren er vores prøve? Prøven her kunne være en fast eller i opløsning.
Der er to almindelige typer gravimetrisk analyse. Begge involverer ændring af analytens fase for at adskille den fra resten af en blanding, hvilket fører til en ændring i masse..
En af disse metoder er nedbørsgravimetri, men den vi virkelig er interesseret i er fordampningsgravimetri.
Fordampningsgravimetri er baseret på termisk eller kemisk nedbrydning af prøven og måling af den resulterende ændring i dens masse..
Alternativt kan vi fange og veje et flygtigt nedbrydningsprodukt. Da frigivelsen af en flygtig art er en væsentlig del af disse metoder, klassificerer vi dem kollektivt som flygtige gravimetriske analysemetoder (Harvey, 2016).
Gravimetriske analyseproblemer er simpelthen støkiometri-problemer med et par ekstra trin.
For at udføre en støkiometrisk beregning har vi brug for koefficienterne for den afbalancerede kemiske ligning.
For eksempel, hvis en prøve indeholder bariumchloriddihydrat (BaClto● HtoO), kan mængden af urenheder opnås ved opvarmning af prøven for at fordampe vandet.
Forskellen i masse mellem den originale prøve og den opvarmede prøve giver os i gram mængden af vand indeholdt i bariumchloridet.
Med en simpel støkiometrisk beregning opnås mængden af urenheder i prøven (Khan, 2009).
Fraktioneret destillation
Fraktioneret destillation er en proces, hvor komponenterne i en flydende blanding adskilles i forskellige dele (kaldet fraktioner) i henhold til deres forskellige kogepunkter.
Forskellen i flygtighed for forbindelserne i blandingen spiller en grundlæggende rolle i deres adskillelse..
Fraktioneret destillation bruges til at rense kemikalier og også til at adskille blandinger for at opnå deres komponenter. Det bruges som laboratorieteknik og i industrien, hvor processen har stor kommerciel betydning.
Dampe fra en kogende opløsning føres gennem en høj søjle, kaldet en fraktioneringskolonne..
Søjlen er pakket med plast- eller glasperler for at forbedre adskillelsen ved at give mere overfladeareal til kondens og fordampning.
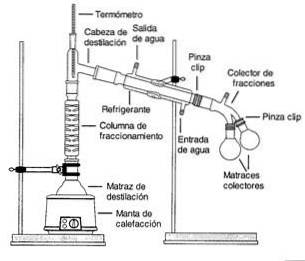
Søjlens temperatur falder gradvist langs dens længde. Komponenter med et højere kogepunkt kondenserer i kolonnen og vender tilbage til opløsning.
Komponenter med lavere kogepunkter (mere flygtige) passerer gennem søjlen og samles tæt på toppen.
Teoretisk forbedrer adskillelsen at have flere perler eller plader, men tilføjelse af plader øger også den tid og energi, der kræves for at gennemføre en destillation (Helmenstine, 2016)..
Referencer
- Anne Marie Helmenstine. (2014, 16. maj). Definition af damptryk. Gendannet fra thoughtco.com.
- Encyclopædia Britannica. (2017, 10. februar). Damptryk. Gendannet fra britannica.com.
- Harvey, D. (2016, 25. marts). Fordampning Gravimetri. Gendannet fra chem.libretexts.
- Helmenstine, A. M. (2016, 8. november). Fraktioneret destillationsdefinition og eksempler. Gendannet fra thoughtco.com.
- Jim Clark, I. L. (2017, 3. marts). Raoults lov. Gendannet fra chem.libretexts.
- Khan, S. (2009, 27. august). Introduktion til gravimetrisk analyse: Volatilisering gravimetri. Gendannet fra khanacademy.
- Louis Gordon, R. W. (2014). Gendannet fra accessscience.com.
- Damptryk. (S.F.). Gendannet fra chem.purdue.edu.


Endnu ingen kommentarer