
Hvad er en koordinat kovalent binding? (med eksempler)

EN koordinere kovalent binding eller koordineringslink eren type binding, hvor et af de vedhæftede atomer forsyner alle de delte elektroner.
I en simpel kovalent binding forsyner hvert atom en elektron til bindingen. På den anden side kaldes atomer, der donerer elektronen til dannelse af en binding, i en koordineringsbinding donoratomet, mens det atom, der accepterer det par elektroner, der skal sammen, kaldes acceptatom (Clark, 2012)..
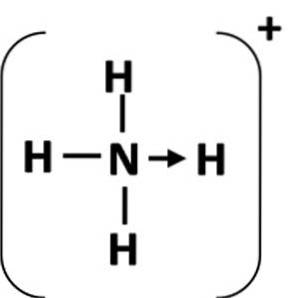
En koordineringsbinding er repræsenteret af en pil, der starter fra donoratomer og slutter ved acceptoratomet (figur 1). I nogle tilfælde kan donoren være et molekyle.
I dette tilfælde kan et atom i molekylet donere elektronparet, hvilket ville være Lewis-basen, mens molekylet med acceptorkapacitet ville være Lewis-syren (Coordinate Covalent Bond, S.F.).
En koordineringsbinding har egenskaber svarende til en simpel kovalent binding. Forbindelser, der har denne type binding, har generelt et lavt smelte- og kogepunkt med en ikke-eksisterende coulombisk interaktion mellem atomerne (i modsætning til den ioniske binding) og forbindelserne er meget opløselige i vand (Atkins, 2017).
Nogle eksempler på koordinerede kovalente bindinger
Det mest almindelige eksempel på en koordineringsbinding er ammoniumionen, som dannes ved kombinationen af et ammoniakmolekyle og en proton fra en syre.
I ammoniak har nitrogenatomet et ensartet par elektroner efter at have afsluttet sin oktet. Doner dette ensomme par til hydrogenionen, så nitrogenatomet bliver en donor. Brintatomet bliver acceptoren (Schiller, S.F.).
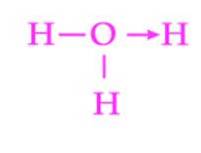
Et andet almindeligt eksempel på en dativbinding er dannelsen af hydroniumionen. Som med ammoniumionen fungerer vandmolekylets frie elektronpar som en donor til protonen, som er acceptoren (figur 2)..
Det skal dog bemærkes, at når koordinationsbindingen er etableret, er alle hydrogener, der er bundet til ilt, nøjagtigt ækvivalente. Når en hydrogenion nedbrydes igen, er der ingen forskelsbehandling mellem hvilke af hydrogenerne der frigives.
Et fremragende eksempel på en Lewis-syre-basereaktion, der illustrerer dannelsen af en koordineret kovalent binding, er dannelsesreaktionen af bortrifluoridadduktet med ammoniak..
Bortrifluorid er en forbindelse, der ikke har en ædelgasstruktur omkring boratomet. Bor har kun 3 par elektroner i sin valensskal, så BF3 siges at være elektronmangel.
Det ikke-delte elektronpar af ammoniaknitrogen kan bruges til at overvinde denne mangel, og der dannes en forbindelse, der involverer en koordineringsbinding..
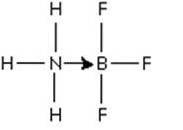
Det par elektroner fra nitrogen doneres til borets tomme p-orbital. Her er ammoniak Lewis-basen, og BF3 er Lewis-syren.
Koordineringskemi
Der er en gren af uorganisk kemi dedikeret udelukkende til undersøgelse af forbindelser, der danner overgangsmetaller. Disse metaller forbinder andre atomer eller molekyler gennem koordinationsbindinger til dannelse af komplekse molekyler..
Disse molekyler er kendt som koordineringsforbindelser, og videnskaben, der studerer dem, kaldes koordinationskemi..
I dette tilfælde er stoffet bundet til metallet, som ville være elektrondonoren, kendt som en ligand, og koordinationsforbindelser er almindeligt kendt som komplekser..
Koordineringsforbindelser inkluderer stoffer såsom vitamin B12, hæmoglobin og klorofyl, farvestoffer og pigmenter og katalysatorer anvendt til fremstilling af organiske stoffer (Jack Halpern, 2014).
Et eksempel på en kompleks ion ville være koboltkomplekset [Co (NHtoCHtoCHtoNHto) 2ClNH3]to+ hvad ville være dichloraminaminendendiaminkobalt (IV).
Koordinationskemi voksede ud af Alfred Werner, en schweizisk kemiker, der undersøgte forskellige forbindelser af cobalt (III) chlorid og ammoniak. Efter tilsætningen af saltsyre fandt Werner, at ammoniak ikke kunne fjernes fuldstændigt. Han foreslog derefter, at ammoniak skulle være tættere bundet til den centrale cobaltion.
Når der imidlertid blev tilsat vandigt sølvnitrat, var et af de dannede produkter fast sølvchlorid. Mængden af dannet sølvchlorid var relateret til antallet af ammoniakmolekyler bundet til cobalt (III) chlorid..
For eksempel når sølvnitrat blev tilsat til CoCl3 6NH3, de tre klorider blev sølvchlorid.
Når sølvnitrat blev tilsat til CoCl3 5NH3, kun 2 af de 3 chlorider dannede sølvchlorid. Da CoCl blev behandlet3.4NH3 med sølvnitrat udfældtes et af de tre chlorider som sølvchlorid.
De resulterende observationer foreslog dannelsen af komplekse eller koordinerende forbindelser. I den interne koordinationssfære, som i nogle tekster også omtales som den første sfære, er liganderne direkte knyttet til det centrale metal.
I den ydre koordinationssfære, undertiden kaldet den anden sfære, er andre ioner knyttet til den komplekse ion. Werner blev tildelt Nobelprisen i 1913 for sin teori om koordination (Introduction to Coordination Chemistry, 2017).
Denne koordinationsteori gør, at overgangsmetaller har to typer valens: den første valens, bestemt af metalets oxidationsnummer, og den anden valens kaldet koordinationsnummeret..
Oxidationsnummeret fortæller hvor mange kovalente bindinger der kan dannes i metallet (eksempel jern (II) producerer FeO) og koordinationsnummeret fortæller hvor mange koordineringsbindinger der kan dannes i komplekset (eksempel jern med koordination nummer 4 producerer [FeCl4]- og [FeCl4]to-) (Koordinationsforbindelser, 2017).
I tilfælde af kobolt har det et koordineringsnummer 6. Derfor blev der i Werner's eksperimenter altid opnået den mængde sølvchlorid, der ville efterlade en hexakoordineret kobolt, når man tilsatte sølvnitrat..
Koordinationsbindingerne af denne type forbindelse har karakteristikken ved at være farvet.
Faktisk er de ansvarlige for den typiske farvning forbundet med et metal (rødt jern, blå kobolt osv.) Og er vigtige for atomabsorption og emission spektrofotometriske tests (Skodje, S.F.).
Referencer
- Atkins, P. W. (2017, 23. januar). Kemisk binding. Gendannet fra britannica.com.
- Clark, J. (2012, september). CO-ORDINATE (DATIV COVALENT) BINDNING. Gendannet fra chemguide.co.uk.
- Koordinere kovalent obligation. (S.F.). Gendannet fra chemistry.tutorvista.
- Koordinationsforbindelser. (2017, 20. april). Gendannet fra chem.libretexts.org.
- Introduktion til koordineringskemi. (2017, 20. april). Gendannet fra chem.libretexts.org.
- Jack Halpern, G. B. (2014, 6. januar). Koordineringsforbindelse. Gendannet fra britannica.com.
- Schiller, M. (S.F.). Koordinere kovalent binding. Gendannet fra easychem.com.
- Skodje, K. (S.F.). Koordinat Kovalent Bond: Definition & Eksempler. Gendannet fra study.com.


Endnu ingen kommentarer