
Hvad er dipoldipolkræfter?
Det dipoldipolkræfter eller Keesom-kræfter er de intermolekylære interaktioner til stede i molekyler med permanente dipolmomenter. Det er en af Van der Waals-kræfterne, og selvom det er langt fra det stærkeste, er det en nøglefaktor, der forklarer de fysiske egenskaber ved mange forbindelser..
Udtrykket "dipol" henviser eksplicit til to poler: en negativ og en positiv. Således taler vi om dipolære molekyler, når de har definerede områder med høje og lave elektrondensiteter, hvilket kun er muligt, hvis elektronerne "migrerer" fortrinsvis til visse atomer: de mest elektronegative..
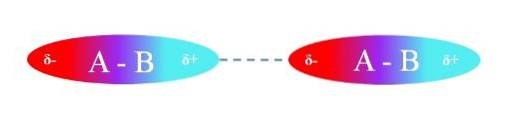
Det øverste billede illustrerer dipol-dipol-interaktioner mellem to A-B-molekyler med permanente dipolmomenter. Ligeledes kan det observeres, hvordan molekylerne er orienteret, så interaktionerne er effektive. Således tiltrækker den positive region δ + den negative region δ-.
Ifølge ovenstående kan det specificeres, at disse typer interaktioner er retningsbestemte (i modsætning til ioniske ladnings-ladningsinteraktioner). Molekylerne i deres omgivelser orienterer deres poler på en sådan måde, at skønt de er svage, giver summen af alle disse interaktioner forbindelsen stor intermolekylær stabilitet..
Dette resulterer i, at forbindelser (organiske eller uorganiske), der er i stand til at danne dipol-dipol-interaktioner, udviser høje kogepunkter eller smeltepunkter..
Artikelindeks
- 1 Dipolmoment
- 1.1 Symmetri
- 1.2 Asymmetri i ikke-lineære molekyler
- 2 Orienteringer af dipolerne
- 3 Interaktioner med hydrogenbindinger
- 4 Referencer
Dipole øjeblik
Dipolmomentet µ af et molekyle er en vektormængde. Med andre ord: det afhænger af retningerne, hvor der er en polaritetsgradient. Hvordan og hvorfor stammer denne gradient? Svaret ligger i bindingerne og i den indre natur af elementernes atomer..
For eksempel er A i det øverste billede mere elektronegativ end B, så i A-B-bindingen er den højeste elektrondensitet placeret omkring A.
På den anden side "giver B" op sin elektronsky og er derfor omgivet af en elektronfattig region. Denne forskel i elektronegativiteter mellem A og B skaber polaritetsgradienten.
Da den ene region er rig på elektroner (δ-), mens den anden er ringe i elektroner (δ +), vises de to poler, som afhængigt af afstanden imellem dem har forskellige størrelser på µ, som bestemmes for hver forbindelse.
Symmetri
Hvis et molekyle af en bestemt forbindelse har µ = 0, siges det at være et apolært molekyle (selvom det har polaritetsgradienter).
For at forstå, hvordan symmetri - og derfor molekylær geometri - spiller en vigtig rolle i denne parameter, er det nødvendigt at overveje AB-bindingen igen..
På grund af forskellen i deres elektronegativiteter er der definerede regioner rige og fattige i elektroner.
Hvad hvis linkene var A-A eller B-B? I disse molekyler ville der ikke være noget dipolmoment, da begge atomer tiltrækker mod dem på samme måde elektronerne i bindingen (hundrede procent kovalent binding).
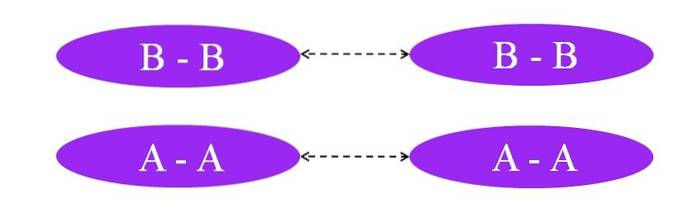
Som det kan ses på billedet, er der hverken i molekyle A-A eller i molekyle BB nu regioner, der er rige eller fattige i elektroner (rød og blå). Her er en anden type styrke ansvarlig for at holde A sammento og Bto: inducerede dipol-dipol-interaktioner, også kendt som London-kræfter eller spredningskræfter.
Tværtimod, hvis molekylerne var af AOA- eller BOB-typen, ville der være frastød mellem deres poler, fordi de har lige ladninger:
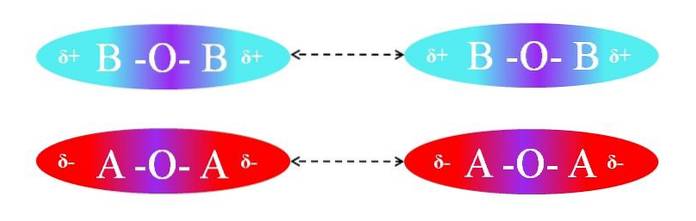
Δ + -regionerne i to BOB-molekyler tillader ikke effektiv dipol-dipol-interaktion; det samme gælder for δ- regionerne i de to AOA-molekyler. På samme måde har begge par af molekyler µ = 0. O-A-polaritetsgradienten annulleres vektorielt med A-O-bindingens.
Derfor kommer dispersionskræfter også i spil i AOA og BOB parret på grund af fraværet af en effektiv orientering af dipolerne.
Asymmetri i ikke-lineære molekyler
Det enkleste tilfælde er CF-molekylets4 (eller skriv CX4). Her har C en tetrahedral molekylær geometri, og elektronrige regioner er ved hjørnerne, specifikt på de elektronegative atomer af F.
Polaritetsgradienten C-F annulleres i en hvilken som helst af retraederens retninger, hvilket får vektorsummen af alle disse til at være lig med 0.
Selvom tetraederens centrum er meget positivt (δ +) og dets hjørner meget negativt (δ-), kan dette molekyle ikke danne dipol-dipol-interaktioner med andre molekyler..
Orienteringen af dipolerne
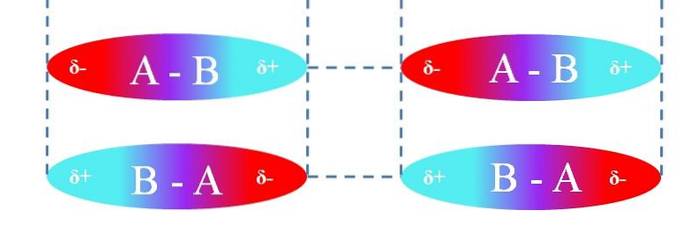
I tilfælde af lineære A-B-molekyler er de orienteret på en sådan måde, at de danner de mest effektive dipol-dipol-interaktioner (som det kan ses på billedet ovenfor). Ovenstående kan anvendes på samme måde for andre molekylære geometrier; for eksempel de vinklede i tilfælde af NO-molekylerto.
Således bestemmer disse interaktioner, om forbindelse A-B er en gas, en væske eller et fast stof ved stuetemperatur..
For forbindelser Ato og Bto (de af de lilla ellipser), er det meget sandsynligt, at de er gasformige. Men hvis dets atomer er meget omfangsrige og let polariserbare (hvilket øger Londons kræfter), så kan begge forbindelser være enten faste eller flydende..
Jo stærkere dipol-dipol-interaktioner er, jo større er sammenhængen mellem molekylerne; ligeledes jo højere forbindelsens smelte- og kogepunkter. Dette skyldes, at der er brug for højere temperaturer for at "bryde" disse interaktioner..
På den anden side får en stigning i temperaturen molekylerne til at vibrere, rotere og bevæge sig oftere. Denne "molekylære agitation" forringer dipolernes retning, og derfor er forbindelsens intermolekylære kræfter svækket..
Hydrogenbindingsinteraktioner
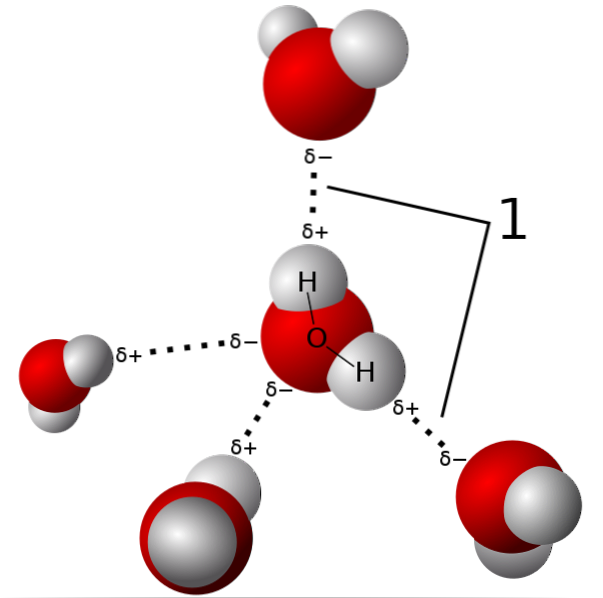
På billedet ovenfor vises fem vandmolekyler, der interagerer med hydrogenbindinger. Dette er en speciel type dipol-dipol-interaktioner. Den elektronfattige region er besat af H; og regionen rig på elektroner (δ-) er optaget af de stærkt elektronegative atomer N, O og F.
Molekyler med N-, O- og F-atomer bundet til H kan danne hydrogenbindinger..
Således er hydrogenbindinger O-H-O, N-H-N og F-H-F, O-H-N, N-H-O osv. Disse molekyler har permanente og meget intense dipolmomenter, som orienterer dem korrekt for at "udnytte" disse broer..
De er energisk svagere end nogen kovalent eller ionisk binding. Skønt summen af alle hydrogenbindinger i fasen af en forbindelse (fast, flydende eller gasformig) får den til at udvise egenskaber, der definerer den som unik..
For eksempel er det tilfældet med vand, hvis hydrogenbindinger er ansvarlige for dets høje kogepunkt og for at være mindre tætte i istilstand end flydende vand; grunden til, at isbjerge flyder i havene.
Referencer
- Dipole-Dipole styrker. Hentet den 30. maj 2018 fra: chem.purdue.edu
- Grænseløs læring. Dipole-Dipole Force. Hentet den 30. maj 2018 fra: courses.lumenlearning.com
- Jennifer Roushar. (2016). Dipole-Dipole styrker. Hentet den 30. maj 2018 fra: sophia.org
- Helmenstine, Anne Marie, Ph.D. (3. maj 2018). Hvad er eksempler på hydrogenbinding? Hentet den 30. maj 2018 fra: thoughtco.com
- Mathews, C. K., Van Holde, K.E. og Ahern, K.G. (2002) Biokemi. Tredje udgave. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 450-452.
- Bruger Qwerter. (16. april 2011). 3D-model hydrogenbindinger i toilet. [Figur]. Hentet den 30. maj 2018 fra: commons.wikimedia.org



Endnu ingen kommentarer