
Hvad er Döbereiner-triader?

Det Döbereiner triader De er grupper med tre kemiske grundstoffer, der har lignende egenskaber. De er en del af de 118 kemiske grundstoffer, idet de er forskellige, der er vist, og deres forbindelser, deres mest fascinerende aspekt.
Ideen med at klassificere elementerne er at behandle deres kemiske egenskaber tilstrækkeligt uden behov for at udvikle et sæt regler og teorier for hver af dem isoleret..
Deres periodiske klassifikation har givet en uhyre nyttig systematisk ramme til at korrelere dem i henhold til nogle få meget enkle og logiske mønstre..
Elementerne er systematisk arrangeret i rækker og kolonner med stigende atomnummer, og der er reserveret plads til nye opdagelser..
I 1815 var kun ca. 30 genstande kendt. Selv om der var en masse information tilgængelig om disse og deres forbindelser, var der ingen tilsyneladende rækkefølge.
Der blev gjort adskillige forsøg på at finde ordren, men det var svært at organisere alt, hvad der var kendt, så mange forskere begyndte at lede efter et mønster i dets egenskaber, der gjorde det muligt at afhjælpe denne situation..
Opdagelsen af Döbereiner-triaderne
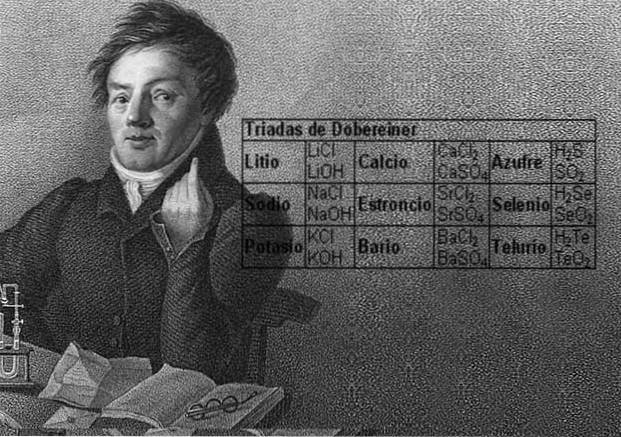
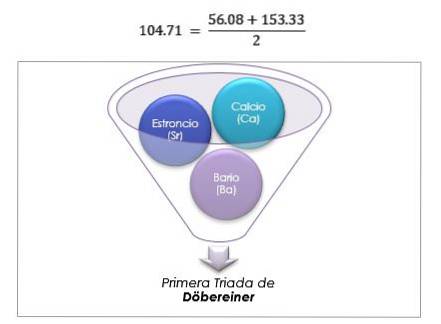
Videnskabsmanden Johann Wolfgang Döbereiner lavede vigtige fund om den numeriske regelmæssighed mellem elementernes atomvægte, han var den første til at bemærke eksistensen af flere grupper på tre grundstoffer, som han kaldte triader, som viste kemiske ligheder.
Disse elementer afslørede et vigtigt numerisk forhold, da vægten af det centrale element, når det var ordnet efter deres ækvivalente vægt eller atomvægt, viste sig at være det omtrentlige gennemsnit af de to resterende elementer i triaden..
I 1817 fandt Döbereiner, at hvis visse grundstoffer blev kombineret med ilt i binære forbindelser, kunne der ses en numerisk sammenhæng mellem de ækvivalente vægte af disse forbindelser.
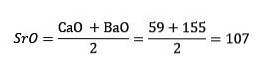
Döbereiner's observation havde først ringe indflydelse på den kemiske verden, men blev senere meget indflydelsesrig. I dag betragtes han som en af pionererne i udviklingen af det periodiske system..
Tolv år senere, i 1829, tilføjede Döbereiner tre nye triader, som er vist nedenfor:
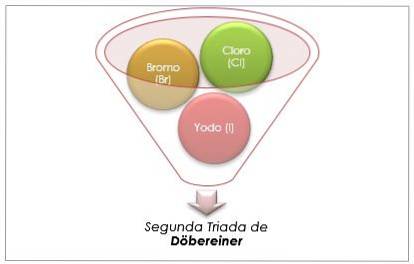
Halogengruppe
Klor, brom og iod har lignende kemiske egenskaber og danner en triade. Disse elementer er meget reaktive ikke-metaller. Hvis de er anført i rækkefølge med stigende relativ masse, er de i rækkefølge efter faldende reaktivitet. Brom har en mellemliggende atommasse mellem klor og iod.

Atommassen af mediumelementet Brom (Br) er lig med gennemsnittet af atommasserne Chlor (Cl) og Jod (I).
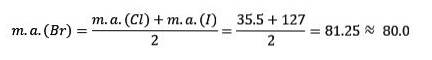
Den opnåede gennemsnitlige værdi er tæt på atommassen af brom (br).
Ligheder i kemiske egenskaber:
- De er alle ikke-metaller.
- De reagerer alle med vand for at danne syrer (for eksempel i: HCI, HBr, HF).
- De har alle en valens på en (for eksempel i: HCI, HBr, HF).
- Alle reagerer med alkalimetaller for at danne neutrale salte (fx NaCl, NaBr, NaI)
Alkali metal gruppe
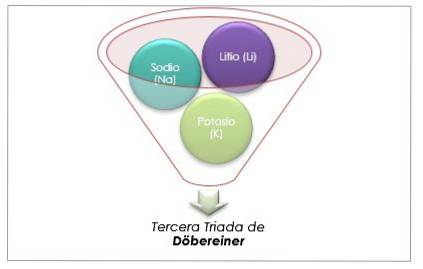
Lithium, natrium og kalium har lignende kemiske egenskaber og danner en triade. Disse grundstoffer er bløde og lette metaller, men meget reaktive..
Hvis de er anført i rækkefølge med stigende relativ atommasse, er de også i rækkefølge med stigende reaktivitet. Natrium har den mellemliggende atommasse mellem lithium og kalium.

Atommassen af det centrale element Sodium (Na) er lig med gennemsnittet af atommassen af Lithium (Li) og Kalium (K).
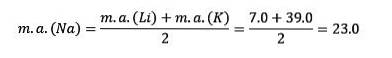
Ligheder i kemiske egenskaber:
- De er alle metaller.
- De reagerer alle med vand til dannelse af alkaliske opløsninger og brintgas..
- De har alle en valens på en (for eksempel i: LiCl, NaCl, KCl).
- Dens carbonater er modstandsdygtige over for termisk nedbrydning.
Gruppe af chalcogener eller amfigener
Svovl, selen og tellur har lignende kemiske egenskaber og danner en triade. Selen har den mellemliggende atommasse mellem svovl og tellur.

Atommassen af det midterste element Selen (Se) er lig med de gennemsnitlige atommasser af Svovl (S) og Tellurium (Te).
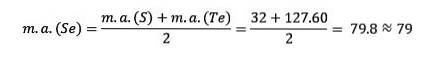
Endnu en gang er den opnåede gennemsnitlige værdi tæt på atommassen af Selen (Se).
Ligheder i kemiske egenskaber:
- Brintkombinationer af disse grundstoffer resulterer i giftige gasser.
- Hvert af disse elementer har 6 valenselektroner.
- Metalliske kvaliteter stiger, når atomnummeret stiger.

Döbereiner bemærkede også, at triader skal afsløre kemiske sammenhænge mellem elementerne såvel som numeriske forhold for at være gyldige..
På den anden side nægtede han at gruppere fluor sammen med klor, brom og iod, som han kunne have gjort af kemiske årsager, fordi han ikke fandt et triadisk forhold mellem atomvægten af fluor og den for disse andre halogener..
Han var også tilbageholdende med at overveje udseendet af triader mellem forskellige elementer, såsom nitrogen, kulstof og ilt, på trods af at de viste et signifikant triadisk numerisk forhold.
Dobereiners arbejde fokuserede på forholdet mellem elementerne i en triade, men gav ingen spor om forholdet mellem triaderne..
Det er tilstrækkeligt at sige, at Döbereiner's forskning etablerede begrebet triader som et stærkt koncept, som flere andre kemikere snart ville tage i betragtning..
Faktisk repræsenterede Döbereiner-triaderne det første trin til at gruppere elementerne i lodrette søjler i det periodiske system og på denne måde etablere et system, der forklarer de kemiske egenskaber og afslører elementernes fysiske forhold..
Udvidelse af triaderne
Andre kemikere udvidede Döbereiner-triaderne til at omfatte mere end de tre originale elementer. F.eks. Blev fluor tilsat til toppen af triaden indeholdende chlor, brom og iod..
Andre "triader" blev produceret, såsom en indeholdende ilt, svovl, selen og tellur. Men der var ikke noget system, der korrelerede dem som en helhed.
En af de største ulemper var, at mange relative atommasser stadig var forkerte for tiden..
Referencer
- Clugston, M. og Flemming, R. (2000) Avanceret kemi. New York, Oxford University Press.
- Johann Wolfgang Döbereiner. Gendannet fra: britannica.com.
- Sauders, N. (2010). Gennembrud inden for videnskab og teknologi: Hvem opfandt det periodiske system?. Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007). Det periodiske system: Dets historie og dens betydning. New York, Oxford University Press.
- Shyamal, A. (2008). Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd..
- Hvad er gruppe 16 i det periodiske system? Hvordan bruges disse elementer? Gendannet fra: quora.com.


Endnu ingen kommentarer