
Organiske salteegenskaber, anvendelser og eksempler

Det organiske salte de er et tæt antal ioniske forbindelser med utallige egenskaber. De stammer tidligere fra en organisk forbindelse, som har gennemgået en transformation, der gør det muligt for den at bære en ladning, og dens kemiske identitet afhænger også af den tilknyttede ion.
To meget generelle kemiske formler for organiske salte er vist på billedet nedenfor. Den første, R-AX, fortolkes som en forbindelse i hvis carbonstruktur et atom, eller gruppe A, bærer en positiv + eller negativ ladning (-).
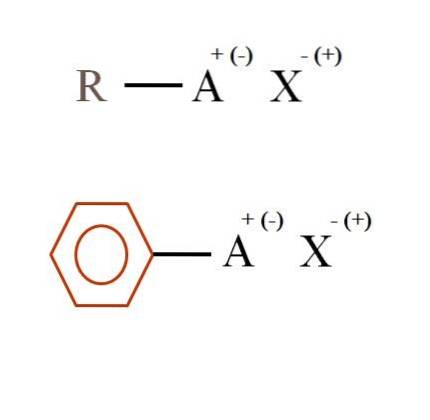
Som det kan ses, er der en kovalent binding mellem R og A, RA, men til gengæld har A en formel ladning, der tiltrækker (eller frastøder) ionen X. Tegnet på ladningen vil afhænge af A's natur og kemisk miljø.
Hvis A var positive, hvor mange X'er kunne det interagere med? Med kun en givet princippet om elektronisk neutralitet (+ 1-1 = 0). Men hvad er X's identitet? Anion X kunne være CO3to-, der kræver to RA-kationer+; et halogenid: F-, Cl-, Br-, etc.; eller endda en anden RA-forbindelse-. Indstillingerne er uberegnelige.
Et organisk salt kan også have aromatisk karakter illustreret af den brune benzenring. Benzoatsaltet af kobber (II), (C6H5COO)toCu består for eksempel af to aromatiske ringe med negativt ladede carboxylgrupper, som interagerer med Cu-kationen.to+.
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 1.1 Høje molekylære masser
- 1.2 Amfifile stoffer og overfladeaktive stoffer
- 1.3 Høje kogepunkter eller smeltepunkter
- 1.4 Surhed og basicitet
- 2 anvendelser
- 3 Eksempler på organiske salte
- 3.1 Carboxylater
- 3.2 Lithiumdiakylcuprater
- 3.3 Sulfoniumsalte
- 3.4 Oxoniumsalte
- 3.5 Aminsalte
- 3.6 Diazoniumsalte
- 4 Referencer
Fysiske og kemiske egenskaber
Fra billedet kan det siges, at organiske salte består af tre komponenter: det organiske, R eller Ar (den aromatiske ring), et atom eller en gruppe, der bærer den ioniske ladning A, og en modion X.
Ligesom identiteten og den kemiske struktur er defineret af sådanne komponenter, afhænger deres egenskaber på samme måde af dem..
Ud fra dette faktum kan visse generelle egenskaber, som langt størstedelen af disse salte opfylder, opsummeres..
Høje molekylære masser
Under antagelse af mono- eller polyvalente uorganiske X-anioner har organiske salte tendens til at have meget større molekylære masser end uorganiske salte. Dette skyldes hovedsageligt kulstofskelettet, hvis enkelte C-C-bindinger og deres hydrogenatomer bidrager med en masse masse til forbindelsen..
Derfor er R eller Ar ansvarlige for deres høje molekylmasser..
Amfifiler og overfladeaktive stoffer
Organiske salte er amfifile forbindelser, det vil sige, deres strukturer har både hydrofile og hydrofobe ender..
Hvad er sådanne ekstremer? R eller Ar repræsenterer det ekstreme hydrofobe, fordi deres C- og H-atomer ikke har stor affinitet for vandmolekyler.
TIL+(-), det ladningsbærende atom eller gruppe er den hydrofile ende, da den bidrager til dipolmomentet og interagerer med vand og danner dipoler (RA+ Åhto).
Når de hydrofile og hydrofobe regioner polariseres, bliver det amfifile salt til et overfladeaktivt middel, et stof, der er meget anvendt til fremstilling af vaskemidler og demulgatorer.
Høje kogepunkter eller smeltepunkter
Ligesom uorganiske salte har organiske salte også høje smelte- og kogepunkter på grund af de elektrostatiske kræfter, der styrer den flydende eller faste fase..
Da der imidlertid er en organisk komponent R eller Ar, deltager andre typer Van der Waals-kræfter (London-kræfter, dipol-dipol, hydrogenbindinger), der konkurrerer på en bestemt måde med elektrostatik..
Af denne grund er de faste eller flydende strukturer i organiske salte i første omgang mere komplekse og varierede. Nogle af dem kan endda opføre sig som flydende krystaller.
Surhed og basicitet
Organiske salte er generelt stærkere syrer eller baser end uorganiske salte. Dette skyldes, at A, for eksempel i aminsalte, har en positiv ladning på grund af sin binding til et yderligere hydrogen: A.+-H. Doner derefter protonen i kontakt med en base for at blive en neutral forbindelse igen:
RA+H + B => RA + HB
H tilhører A, men det er skrevet, da det deltager i neutraliseringsreaktionen.
På den anden side RA+ Det kan være et stort molekyle, der ikke er i stand til at danne faste stoffer med et tilstrækkeligt stabilt krystalgitter med hydroxyl- eller hydroxylanionen OH-.
Når dette er tilfældet, RA saltet+Åh- opfører sig som en stærk base; selv så basisk som NaOH eller KOH:
RA+Åh- + HCI => RACl + HtoELLER
Bemærk i den kemiske ligning, at anionen Cl- erstatter OH-, danner saltet RA+Cl-.
Ansøgninger
Anvendelsen af organiske salte vil variere alt efter identiteten af R, Ar, A og X. Derudover afhænger deres anvendelse også af typen af fast stof eller væske, de danner. Nogle generaliteter i denne henseende er:
-De tjener som reagenser til syntese af andre organiske forbindelser. RAX kan fungere som en "donor" for R-kæden for at føje til en anden forbindelse, der erstatter en god forlader gruppe.
-De er overfladeaktive stoffer, så de kan også bruges som smøremidler. Metalsalte af carboxylater anvendes til dette formål.
-De giver mulighed for at syntetisere en bred vifte af farvestoffer.
Eksempler på organiske salte
Carboxylater
Carboxylsyrer reagerer med et hydroxid i en neutraliseringsreaktion, hvilket giver anledning til carboxylatsalte: RCOO- M+; hvor M+ kan være ethvert metalkation (Na+, Pbto+, K+, osv.) eller ammoniumkationen NH4+.
Fedtsyrer er lange alifatiske kædecarboxylsyrer, de kan være mættede og umættede. Blandt de mættede er palmitinsyre (CH3(CHto)14COOH). Dette stammer fra palmitatsaltet, mens stearinsyre (CH3(CHto)16COOH danner stearatsaltet. Sæber består af disse salte.
For tilfældet med benzoesyre, C6H5COOH (hvor C6H5- er en benzenring), når den reagerer med en base, danner den benzoatsalte. I alle carboxylater er gruppen -COO- repræsenterer A (RAX).
Lithium diakylcuprates
Lithiumdiakylcuprat er nyttigt i organisk syntese. Dens formel er [R-Cu-R]-Li+, hvor kobberatomet bærer en negativ ladning. Her repræsenterer kobberet atom A i billedet.
Sulfoniumsalte
De dannes ved omsætning af et organisk sulfid med et alkylhalogenid:
RtoS + R'X => RtoR'S+x
For disse salte bærer svovlatomet en positiv formel ladning (S+) ved at have tre kovalente bindinger.
Oxonium salte
Ligeledes reagerer ethere (de iltede analoger af sulfider) med hydracider til dannelse af oxoniumsalte:
ROR '+ HBr <=> RO+HR '+ Br-
Den sure proton af HBr er kovalent bundet til etherets oxygenatom (RtoELLER+-H), oplader det positivt.
Aminsalte
Aminer kan være primære, sekundære, tertiære eller kvaternære, ligesom deres salte. Alle er karakteriseret ved at have et H-atom bundet til nitrogenatomet.
Således RNH3+x- er et primært aminsalt; RtoNHto+x-, sekundær amin; R3NH+x-, tertiær amin; og R4N+x-, kvaternær amin (kvaternært ammoniumsalt).
Diazoniumsalte
Endelig diazoniumsalte (RNto+x-) eller aryldiazonium (ArNto+x-), repræsenterer udgangspunktet for mange organiske forbindelser, især azofarvestoffer.
Referencer
- Francis A. Carey. Organisk kemi. (Sjette udgave, side 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Wikipedia. (2018). Salt (kemi). Hentet fra: en.wikipedia.org
- Steven A. Hardinger. (2017). Illustreret ordliste for organisk kemi: salte. Gendannet fra: chem.ucla.edu
- Chevron Oronite. (2011). Carboxylater. [PDF]. Gendannet fra: oronite.com



Endnu ingen kommentarer