
Spektralserie
Det spektral serie De består af et sæt farvede linjer på en mørk baggrund eller af lyse striber adskilt af mørke områder, der udsender lys fra alle slags stoffer..
Disse linjer visualiseres ved hjælp af et spektrometer, et apparat, der består af et prisme eller et findelt gitter, der er i stand til at adskille de forskellige komponenter i lys..
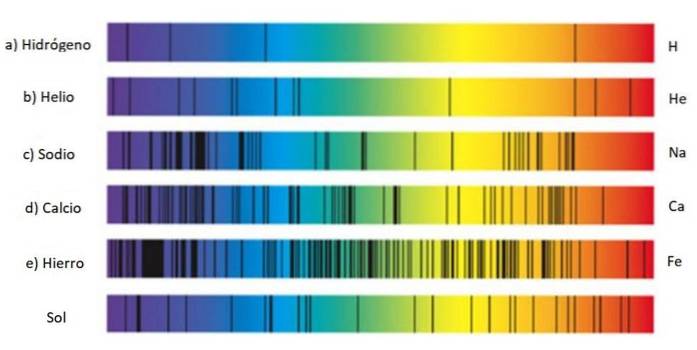
Disse sæt linjer kaldes spektrum og hvert stof har et karakteristisk spektrum, en slags fingeraftryk, der tjener til at identificere dets tilstedeværelse i lyset, der kommer fra et objekt. Dette skyldes, at hvert atom har sin egen elektronkonfiguration og tilladte energiniveauer..
Derfor er det at finde spektrallinjer en teknik, der er meget brugt af astronomer til at finde ud af sammensætningen af stjerner gennem det lys, de udsender. Faktisk kommer alt, hvad astronomer ved om stjerner, fra deres spektre, hvad enten det er emission eller absorption..
Oprindelsen af spektrene
Tilstedeværelsen af spektrene skyldes den atomare konfiguration. Faktisk holdes elektronerne omkring kernen i områder, der kaldes orbitaler, placeret adskilt fra ham.
For eksempel i hydrogen, det enkleste element, er orbitalradier angivet med 0,053 ∙ nto nanometer, hvor n = 1, 2, 3, 4,…. Mellemliggende værdier mellem disse er ikke tilladt, det er derfor, det siges, at orbitalerne er kvantiseret. Også energitilstanden for hver orbital kvantificeres.
Sådanne begrænsninger får elektroner til at opføre sig både som partikler og også som bølger, ligesom lys. Elektroner kan dog gå fra en orbital til en anden og ændre atomens energitilstand..
Absorption og emission af elektromagnetisk energi
For eksempel, hvis en elektron går fra en mere intern orbital med lavere energi til en mere ekstern og energisk, er det nødvendigt, at den erhverver den nødvendige elektromagnetiske energi, som er lagret i atomet. Denne proces kaldes absorption.
På den anden side, hvis elektronen går fra en ydre orbital til en mere indre, udsendes en foton i overgangen i form af lys, hvilket er den energi, der svarer til forskellen i energi mellem orbitalerne. Bølgelængden svarer til denne forskel og er givet ved:

- E er energi
- λ er bølgelængden
- h er Plancks konstant
- c er lysets hastighed
Typer af spektre
Der produceres både absorptions- og emissionsspektre, som afhænger af bestemte parametre for objektet eller stoffet, såsom densitet og temperatur. Spektret for en tynd gas er forskellig fra et fast stof ved høj temperatur.
Kontinuerligt spektrum
Nogle kilder udsender spektre, hvis farvede linjer skifter glat og indeholder alle farver. Dette kaldes et kontinuerligt spektrum, for eksempel det, der produceres af glødetråden til en glødepære.
Emissionsspektrum
Det er den, som visse varme stoffer udsender og består af et par linjer med en bestemt bølgelængde.
Denne type spektrum produceres af varme, tynde gasser som dem, der fylder lysstofrør. Aurora borealis er et andet eksempel på emission, der opstår i gasser i Jordens øvre atmosfære. Nogle interstellare gasskyer producerer også emissionsspektre..
Absorptionsspektrum
Dette spektrum er det, der modtages, når lys fra en meget varm, tæt genstand ledes gennem en køligere gas. I det observeres næsten alle farverne, men nogle ser ud til at være formindsket, og mørke frynser vises i de bølgelængder, der absorberes af gassens atomer eller molekyler..
Kirchoffs love om spektroskopi
Kirchoffs spektroskopilovgivning indikerer under hvilke betingelser de forskellige spektre beskrevet ovenfor dannes:
- Kontinuerlige spektre: de udsendes af ethvert objekt ved højt tryk og temperatur.
- Emissionsspektre: produceres af en varm gas ved lavt tryk, der udsender linjer i veldefinerede bølgelængder svarende til de elektroniske overgange svarende til hvert element, der udgør gassen.
- Absorptionsspektre: produceres af gasser ved lave temperaturer nær kilder til kontinuerlig stråling. Gasatomer eller molekyler absorberer kun visse bølgelængder.
Emissionsspektret af brint
Emissionsspektret for brint er særlig vigtigt, da det er det mest rigelige element i hele universet og indeholder en masse vigtig information om stjernerne og Mælkevejen..
Serien af linjer i hydrogenspektret blev opdaget af forskellige forskere og bærer hver sit navn.
Balmer-serien
Brint udsender flere linjer i det synlige spektrum: når elektronen henfalder fra orbital 3 til orbital 2 udsender det rødt lys, hvis bølgelængde er 656,6 nm, og hvis det henfalder fra orbital 4 til orbital 2, udsender det blåt lys på 486,1 nm.

I 1885 (før Bohr foreslog sin teori) fandt den schweiziske matematiker og professor Johann Balmer (1825-1898) ved forsøg og fejl en formel til at bestemme bølgelængderne λ af disse linjer:

Hvor:
- R er Rydberg-konstanten: 1.097 × 107 m-1
- n = 3, 4, 5…., dvs. n ≥ 3 (heltal).
For eksempel for n = 3 i Balmers ligning:

Svarende til den røde linje til højre, vist i figuren ovenfor. Opdagelsen af Balmer-serien fik andre forskere til at søge efter linjer i resten af spektret efter brint og andre gasser..
Lyman-serien
Bemærk, at spektret af hydrogen vist i figuren indeholder ultraviolette linjer, de to yderst til venstre, hvis bølgelængder er 397,0 nm og 388,9 nm. nm.
Faktisk svarer disse ultraviolette linjer til den såkaldte Lyman-serie, der blev opdaget i 1906 af fysikeren Theodore Lyman. Dens formel er:

Paschen-serien
Paschen-serien blev opdaget af den tyske fysiker Friederich Paschen i 1908 og er gyldig for n ≥ 4, det vil sige: n = 4, 5, 6 ...

Paschens linjer er i det nærmeste infrarøde område, og det endelige niveau er n = 3, det vil sige, deres værdier opstår, når elektronen henfalder fra højere niveauer til n = 3. Da Lyman-serien er i ultraviolet, konkluderes det at Balmers serie ligger mellem Lyman og Paschen.
Brackett-serien
Denne serie, der blev opdaget i 1922 af Frederick Brackett, en amerikansk fysiker, er placeret langt i det infrarøde og består af de spektrale linjer, der svarer til brintovergangene, der starter ved n = 5 og fortsætter:

Pfund-serien
Pfund-serien blev fundet i 1924 af den nordamerikanske fysiker August Hermann Pfund og henviser til de overgange, der starter ved n = 5, i det langt infrarøde bånd:

- Arny, T. 2017. Udforskninger: En introduktion til astronomi. 8. plads Ed. McGraw Hill.
- Bauer, W. 2011. Fysik til ingeniørvidenskab. Bind 2. Mc Graw Hill.
- Chang, R. 2013. Kemi. 11. Udgave. Mc Graw Hill Uddannelse.
- Sears, Zemansky. 2016. Universitetsfysik med moderne fysik. 14. Red. Bind 2. Pearson.
- Windows åbner for universet. De forskellige klasser af spektre. Gendannet fra: media4.obspm.fr.

Endnu ingen kommentarer