
Ammoniumsulfat Kemisk struktur, egenskaber og anvendelser

Det ammoniumsulfat Det er et ternært ammoniakalt uorganisk salt af svovlsyre. Dens kemiske formel er (NH4)toSW4. Derfor siger de støkiometriske proportioner, at der for hver sulfatanion er to ammoniumkationer, der interagerer med den. Dette tillader saltets neutralitet ((+1) ∙ 2 + (-2)).
Dens nomenklatur skyldes, at det er et salt afledt af HtoSW4, ændring af suffikset "uric" ved "ato". Således erstattes de to indledende protoner med NH4+, produkt fra reaktion med ammoniak (NH3). Så den kemiske ligning til syntese er: 2 NH3 + HtoSW4 => (NH4)toSW4
Ammoniumsulfat er en nitrogen- og svovlbuffer, der begge er vigtige inden for jordkemi og gødning..
Artikelindeks
- 1 Kemisk struktur
- 2 Fysiske og kemiske egenskaber
- 2.1 Molekylvægt
- 2.2 Fysisk udseende
- 2.3 Lugt
- 2.4 Smeltepunkt
- 2.5 Opløselighed
- 2.6 Tæthed
- 2.7 Damptryk
- 2.8 Flammepunkt
- 2,9 pH
- 2.10 Stabilitet
- 2.11 Nedbrydning
- 2.12 Korrosion
- 3 anvendelser
- 3.1 I landbruget
- 3.2 Som et analytisk reagens
- 3.3 I udfældning og isolering af proteiner
- 3.4 I industrien
- 3.5 Andre anvendelser
- 4 Referencer
Kemisk struktur
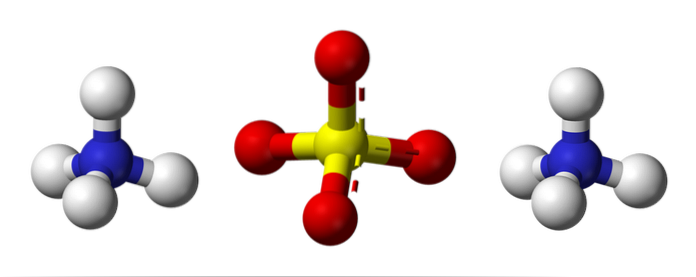
Det øverste billede illustrerer de molekylære geometrier af NH-ioner4+ Også4to-. De røde kugler svarer til iltatomer, de hvide kugler til brintatomer, den blå til nitrogenatomet og den gule til svovlatomet.
Begge ioner kan betragtes som to tetraedre og har således tre enheder, der interagerer for at danne et orthorhombisk krystalarrangement. Sulfatanionen er SO4to- og er i stand til at donere eller acceptere fire hydrogenbindinger, ligesom NH-kationen4+.
Fysiske og kemiske egenskaber
Molekylær vægt
132,134 g / mol.
Fysisk fremtoning
Solid hvid. Hvide eller brune orthorhombiske krystaller afhængigt af urenhedsniveauer.
Lugt
Toilet.
Smeltepunkt
280 ° C Dette smeltepunkt, lavt sammenlignet med andre ioniske forbindelser, skyldes, at det er et salt med monovalente kationer (+1) og med forskellige ioner i deres størrelse, hvilket får det faste stof til at have en lav krystallinsk gitterenergi..
Opløselighed
76,4 g / 100 g vand ved 25 ° C Denne affinitet for vand skyldes dets store kapacitet til at opløse ammoniumioner. På den anden side er den uopløselig i acetone og alkohol; i opløsningsmidler, der er mindre polære end vand.
Massefylde
1,77 g / cm3 ved 25 ºC.
Damptryk
1.871 kPa ved 20 ºC.
Flammepunkt
26 ºC.
pH
5,0-6,0 (25 ° C. 1 M opløsning). Den let sure pH skyldes hydrolyse af NH4+ i vand og producerer H3ELLER+ ved lave koncentrationer.
Stabilitet
Stabil under passende miljøforhold. I kontakt med stærke oxidanter kan det antændes.
Nedbrydning
Det begynder at nedbrydes ved 150 ° C og frigiver giftige dampe af svovloxid, nitrogenoxid og ammonium.
Korrosion
Angriber ikke jern eller aluminium.
Ansøgninger

I landbruget
- Ammoniumsulfat anvendes som gødning i alkalisk jord. Ammoniumsaltet har i sin sammensætning 21% nitrogen og 24% svovl. Der er imidlertid forbindelser, der tilvejebringer en større mængde nitrogen end ammoniumsulfat; fordelen ved sidstnævnte er dens høje koncentration af svovl.
- Svovl er essentiel i proteinsyntese, da adskillige aminosyrer - såsom cystin, methionin og cystein - har svovl. Af disse grunde er ammoniumsulfat fortsat en af de vigtigste gødninger.
- Det bruges i afgrøderne af hvede, majs, ris, bomuld, kartofler, hamp og frugttræer.
- Det sænker pH af alkaliske jordarter på grund af dets bidrag til nitrifikationsprocessen udført af mikrober. Ammonium (NH4+) for at producere nitrat (NO3-) og slip H+: 2 NH4+ + 4. pladsto => 2NO3- + 2HtoO + 4H+. Forøgelse af brintkoncentrationen sænker pH i alkaliske jordarter og tillader mere brug.
- Ud over dets anvendelse som gødning fungerer ammoniumsulfat som et supplement til opløselige insekticider, herbicider og fungicider, der sprøjtes på afgrøder..
- Sulfat er i stand til at sekvestrere ioner, der er til stede i jorden og i vandingsvand, der er nødvendige for visse patogeners levetid. Blandt de ioner, som ammoniumsulfat fanger, er Cato+, Mgto+, troto+ og troen3+. Denne handling forbedrer den mikrobicide virkning af de nævnte midler..
Som et analytisk reagens
Ammoniumsulfat fungerer som et udfældningsmiddel i elektrokemisk analyse, i mikrobiologisk dyrkningsmedium og ved fremstilling af ammoniumsalte..
I udfældning og isolering af proteiner
Ammoniumsulfat anvendes til isolering og oprensning af proteiner, især plasmaproteiner. En mængde ammoniumsulfat tilsættes til plasmaet for at bringe det til en bestemt koncentration; således forårsages udfældningen af en gruppe proteiner.
Bundfaldet opsamles ved centrifugering, og en yderligere mængde ammoniumsulfat tilsættes til supernatanten, og ved en ny koncentration forekommer udfældningen af en anden gruppe proteiner..
Gentagelsen af den foregående proces på en sekventiel måde muliggør som et resultat opnåelse af forskellige fraktioner af plasmatiske proteiner.
Før de nye teknologier inden for molekylærbiologi dukkede op, tillod denne procedure isolering af plasmaproteiner af stor betydning i medicin, for eksempel: immunglobuliner, koagulationsfaktorer osv..
I branchen
Ammoniumsulfat virker ved at forsinke starten på ilden i tekstilindustrien. Det bruges som tilsætningsstof i galvaniseringsindustrien. Det bruges også til produktion af hydrogenperoxid, ammoniumchlorid osv..
Andre anvendelser
- Ammoniumsulfat anvendes som et osmotisk trykregulerende middel og som et saltudfældningsmiddel..
- I form af ammoniumlaurylsulfat reducerer det overfladespændingen af vandet, hvilket muliggør adskillelse af forurenende stoffer ved at øge vandets hårdhed..
- Det er et antikorrosivt middel.
- Det bruges som et fødevaretilsætningsstof, der regulerer surheden i meldej og brød.
Referencer
- OECD SIDS. (Oktober 2004). Ammoniumsulfat. [PDF]. Hentet den 27. april 2018 fra: inchem.org
- Mosaikfirmaet. (2018). Ammoniumsulfat. Hentet den 27. april 2018 fra: cropnutrition.com
- Wikipedia. (2018). Ammoniumsulfat. Hentet den 27. april 2018 fra: en.wikipedia.org
- Pubchem. (2018). Ammoniumsulfat. Hentet den 27. april 2018 fra: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23. juli 2015). [Figur]. Hentet den 27. april 2018 fra: flickr.com
- Paula Papp. (22. februar 2017). Ammoniumsulfat applikationer og anvendelser. Hentet den 27. april 2018 fra: business.com



Endnu ingen kommentarer