
Ferriesulfatstruktur, egenskaber, risici og anvendelser

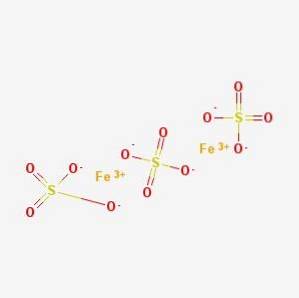
Det jernsulfat, jern (III) sulfat, Mars vitriol eller Mars caparrosa er en uorganisk forbindelse med formlen Feto(SO4)3. Hvert jernatom har tre ionbindinger med sulfat.
Jernsulfat findes i en bred vifte af mineraler, hovedsageligt i mineralerne pyrit og marcasit, hvor jernholdigt sulfat er forbundet med jernoxid (Fe0).
Andre mineraler såsom coquimbit, kornelit og lausenit er kilder til jernsulfat nona, hepta og pentahydrat. På den anden side kan den findes i mineraler som Mikasita, hvor den danner en blanding med aluminium (Ferric sulfate Formula, 2005-2017).
Jernsulfat ekstraheres for det meste fra naturen, men det kan også fremstilles ved inddampning af jernoxid og svovlsyre. Det fremstilles generelt ved behandling af jernholdigt sulfat og et oxidationsmiddel med svovlsyre ved forhøjede temperaturer som følger:
2FeSO4 + HtoSW4 + HtoELLERto → Troto(SW4)3 + 2HtoELLER
Ferri-sulfatopløsninger fremstilles ved at injicere chlorgas i en ferrosulfatopløsning.
I vandig opløsning Feto (SW4)3 adskilles i Fe-ioner3+ (aq) og SO4to- (aq). Sulfationerne vil blive solvatiseret ved hydrogenbindinger med vand, og jernionerne vil danne hexahydratkomplekset (III), [Fe (H2O) 6]3+ (Hvad sker der med jern (III) sulfat (jernsulfat) i vandig opløsning?, 2015).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber
Ferriesulfat er et hygroskopisk fast stof, hvis udseende og aroma kan variere afhængigt af mængden af vand indeholdt i saltet..
De mest almindelige former, hvor jern (III) sulfat findes i naturen, er hydreret penta og ingen. I et sådant tilfælde kan krystallerne af denne forbindelse have en gul farve. Når den er i vandfri form, har den en grå farve (Ferric sulfate, 2016).

Jernsulfatmolekyler danner rhombiske eller rombohedriske krystaller. Dens vandfri form har en molekylvægt på 399,858 g / mol, dens hydratiserede penta og ingen form har en molekylvægt på henholdsvis 489,960 g / mol og 562,000 g / mol (Royal Society of Chemistry, 2015).
Densiteten er 3,097 g / ml (vandfri), og dens smeltepunkt er 480 ° C (vandfri) og 175 ° C (ikke hydreret). Det er let opløseligt i vand og alkohol, mens det er meget let opløseligt i acetone og ethylacetat og uopløseligt i svovlsyre (National Center for Biotechnology Information, S.F.).
Jern III-sulfat er surt, ætsende over for kobber, kobberlegeringer, blødt stål og galvaniseret stål (FERRIC SULFATE, 2016).
Reaktivitet og farer
Jernsulfat er en stabil ikke-brændbar forbindelse, men når den opvarmes, udsender den giftige dampe af jern og svovloxider..
Det er meget farligt i tilfælde af indtagelse, kontakt med hud og øjne (irriterende) og indånding. Stoffet er giftigt for lunger og slimhinder, og gentagen eller langvarig eksponering for stoffet kan forårsage skader på disse organer..
I tilfælde af kontakt med øjnene skal kontaktlinserne kontrolleres og fjernes. En øjesalve bør ikke anvendes, og der skal søges lægehjælp..
I tilfælde af hudkontakt skal den straks vaskes med rigeligt vand på en skånsom måde og pas på ikke at bruge sæbe, der ikke er slibende. Dæk irriteret hud med et blødgørende middel, hvis irritation vedvarer, søg lægehjælp.
Hvis hudkontakten er svær, skal den vaskes med et desinfektionsmiddel og sæbe og dække den forurenede hud med en antibakteriel creme. Søg lægehjælp.
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område og søge øjeblikkelig lægehjælp..
Fremkald ikke opkastning ved indtagelse, men løsn snarere tøj som f.eks. En skjortekrave, slips eller bælte. Hvis offeret ikke trækker vejret, skal der udføres genoplivning fra mund til mund. Som i de tidligere tilfælde bør øjeblikkelig lægehjælp søges..
Denne type forbindelse kræver ikke en bestemt type opbevaring. Hylder eller skabe, der er stærke nok til at understøtte kemikaliets vægt, anvendes, hvilket sikrer, at det ikke er nødvendigt at anstrenge sig for at nå materialerne, og at hylderne ikke er overbelastede (Material Safety Data Sheet Ferric sulfate, 2013).
Ansøgninger
Jernsulfat anvendes i industrien til behandling af vand og spildevand på grund af dets evne som flokkuleringsmiddel og koaguleringsmiddel og til at eliminere lugt af svovlforbindelser..
Jernsulfat anvendes som et fast separationsmiddel og oxidationsmiddel. Derudover bruges dette salt i pigmentindustrien og i medicin kan det bruges som en snerpende og styptisk.
I Ibricevics arbejde (2000) blev 70 eksponerede karies primære molære tænder behandlet uden symptomer og uden tegn på rodresorption hos børn i alderen 3 til 6 år (hovedalder: 4,3 år) behandlet med konventionel pulpotomi.
De brugte en 15,5% jernsulfatopløsning (anvendt i 15 sekunder i 35 tænder) og formocresolopløsning (5-minutters Buckley-formelprocedure til de næste 35 tænder) som pulpotomimidler..
I begge grupper blev massestubbe dækket med zinkoxid eugenolpasta. De permanente restaureringer var kroner i rustfrit stål. Den kliniske kontrol var hver tredje måned, og den radiografiske opfølgning var seks og tyve måneder efter behandlingen..
Resultaterne i denne periode afslørede en 100% klinisk succesrate i begge grupper. Den radiografiske succesrate var 97,2% i begge grupper, mens tilfældene i 2,8% viste intern rodresorption.
Jernsulfat og jarosit er blevet påvist af de to Martian Rovers Spirit and Opportunity. Disse stoffer er indikative for stærkt oxiderende forhold på Mars overflade..
Referencer
- Jernsulfat. (2016). Hentet fra kemikaliebog: chemicalbook.com.
- FERRISK SULFAT. (2016). Hentet fra cameochemicals: cameochemicals.noaa.gov.
- Ferriesulfatformel. (2005-2017). Hentet fra softschools: softschools.com.
- Ibricevic H1, a.-J. Q. (2000). Ferri sulfat som pulpotomi middel i primære tænder: tyve måneders klinisk opfølgning. Clin Pediatr Dent 24 (4), 269-272.
- Sikkerhedsdatablad Ferric sulfat. (2013, 21. maj). Hentet fra sciencelab.
- National Center for Biotechnology Information. (S.F.). PubChem Compound Database; CID = 24826. Hentet fra PubChem.
- Royal Society of Chemistry. (2015). Jern (III) sulfat. Hentet fra chemspider.
- Hvad sker der med jern (III) sulfat (jernsulfat) i vandig opløsning? (2015, 8. august). Hentet fra stackexchange: stackexchange.com.


Endnu ingen kommentarer