
Sølvsulfid (Ag2S) struktur, egenskaber og anvendelser
Det sølvsulfid er en uorganisk forbindelse, hvis kemiske formel er AgtoS. Den består af et grå-sort fast stof dannet af kationer Ag+ og S anionerto- i forholdet 2: 1. Sto- er meget beslægtet med Ag+, fordi begge er bløde ioner og formår at stabilisere sig med hinanden.
Sølvpynt har tendens til at blive mørkere og mister deres karakteristiske glans. Farveændringen er ikke et produkt af oxidation af sølv, men af dets reaktion med hydrogensulfid til stede i miljøet ved lave koncentrationer; dette kan komme fra rådnende eller nedbrydning af planter, dyr eller fødevarer, der er rige på svovl.

HtoS, hvis molekyle bærer et svovlatom, reagerer med sølv ifølge følgende kemiske ligning: 2Ag (s) + HtoS (g) => AgtoS (s) + Hto(g)
Derfor er AgtoS er ansvarlig for de sorte lag dannet på sølv. Imidlertid kan dette sulfid i naturen også findes i mineralerne Acantite og Argentite. De to mineraler adskiller sig fra mange andre ved deres skinnende sorte krystaller, som den i det faste stof i billedet ovenfor..
AGtoS har polymorfe strukturer, attraktive elektroniske og optoelektroniske egenskaber, er en halvleder og lover at være et materiale til fremstilling af solcelleanordninger, såsom solceller..
Artikelindeks
- 1 Struktur
- 2 egenskaber
- 2.1 Molekylvægt
- 2.2 Udseende
- 2.3 Lugt
- 2.4 Smeltepunkt
- 2.5 Opløselighed
- 2.6 Struktur
- 2.7 Brydningsindeks
- 2.8 Dielektrisk konstant
- 2.9 Elektronik
- 2.10 Reduktionsreaktion
- 3 Nomenklatur
- 3.1 Systematik
- 3.2 Lager
- 3.3 Traditionel
- 4 anvendelser
- 5 Referencer
Struktur
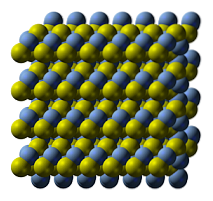
Det øverste billede illustrerer sølvsulfids krystalstruktur. De blå kugler svarer til Ag-kationerne+, mens de gule til S-anionerneto-. AGtoS er polymorf, hvilket betyder, at den kan anvende forskellige krystalsystemer under bestemte temperaturforhold..
Hvordan? Gennem en faseovergang. Ionerne arrangeres på en sådan måde, at stigningen i temperatur og det faste stofs vibrationer ikke forstyrrer den elektrostatiske tiltræknings-frastødningsbalance. Når dette sker siges det, at der er en faseovergang, og det faste stof udviser derfor nye fysiske egenskaber (såsom glans og farve)..
AGtoS ved normale temperaturer (under 179 ° C) har den en monoklinisk krystallinsk struktur (α- AgtoS). Ud over denne faste fase er der to andre: bcc (kubisk centreret på kroppen) mellem 179 og 586 ºC og fcc (kubisk centreret på ansigterne) ved meget høje temperaturer (δ- AgtoS).
Mineralet argentit består af fcc-fasen, også kendt som β-AgtoS. Når det er afkølet og omdannet til acanthit, hersker dets strukturelle træk kombineret. Derfor eksisterer begge krystallinske strukturer sammen: monoklin og bcc. Derfor kommer sorte faste stoffer med lyse og interessante overtoner frem..
Ejendomme
Molekylær vægt
247,80 g / mol
Udseende
Gråsorte krystaller
Lugt
Toilet.
Smeltepunkt
836 ° C. Denne værdi stemmer overens med det faktum, at AgtoS er en forbindelse med ringe ionisk karakter og smelter derfor ved temperaturer under 1000 ° C.
Opløselighed
Kun i vand 6.21 ∙ 10-femten g / L ved 25 ° C Det vil sige, at mængden af det sorte faste stof, der opløses, er ubetydelig. Dette skyldes igen Ag-S-bindingens lave polære karakter, hvor der ikke er nogen signifikant forskel i elektronegativitet mellem de to atomer..
Også AgtoS er uopløselig i alle opløsningsmidler. Intet molekyle kan effektivt adskille dets krystallinske lag i Ag-ioner+ og Sto- solvatiseret.
Struktur
På billedet af strukturen kan du også se fire lag af S-Ag-S-bindinger, der bevæger sig over hinanden, når det faste stof udsættes for kompression. Denne adfærd betyder, at den til trods for at være en halvleder er duktil som mange metaller ved stuetemperatur..
S-Ag-S lag passer ordentligt på grund af deres vinkelgeometrier, som ses som en zigzag. Da der er en kompressionskraft, bevæger de sig på en forskydningsakse og forårsager således nye ikke-kovalente interaktioner mellem sølv- og svovlatomer..
Brydningsindeks
2.2
Dielektrisk konstant
6
Elektronisk
AGtoS er en amfoter halvleder, dvs. den opfører sig som om den var af typen n og af typen s. Derudover er det ikke skørt, så det er blevet undersøgt for dets anvendelse i elektroniske enheder..
Reduktionsreaktion
AGtoS kan reduceres til metallisk sølv ved at bade de sorte stykker med varmt vand, NaOH, aluminium og salt. Følgende reaktion finder sted:
3AgtoS (s) + 2Al (s) + 3HtoO (l) => 6Ag (s) + 3HtoS (ac) + AltoELLER3(s)
Nomenklatur
Sølv, hvis elektronkonfiguration er [Kr] 4d105s1, det kan kun miste en elektron: dens yderste orbitale 5'ere. Kationen Ag+ efterlades med en elektronkonfiguration [Kr] 4d10. Derfor har den en unik valens på +1, der bestemmer, hvad dens forbindelser skal kaldes..
Svovl har derimod elektronisk konfiguration [Ne] 3sto3p4, og det tager to elektroner at fuldføre sin valensoktet. Når den får disse to elektroner (fra sølv), omdannes den til sulfidanionen, Sto-, med [Ar] indstilling. Det vil sige, det er isoelektronisk til ædelgasargonen.
Så AgtoS skal kaldes i henhold til følgende nomenklaturer:
Systematisk
Abesulfid af gavsølv. Her betragtes antallet af atomer for hvert element, og de er markeret med præfikser af græske tællere.
Lager
Sølvsulfid. Da den har en unik valens på +1, er den ikke specificeret med romertal i parentes: sølv (I) sulfid; hvilket er forkert.
Traditionel
Sølvsulfidico. Da sølv "fungerer" med en valens på +1, tilføjes suffikset -ico til dets navn. argentum På latin.
Ansøgninger
Nogle af de nye anvendelser til AgtoS er som følger:
-De kolloide opløsninger af dets nanopartikler (med forskellige størrelser) har antibakteriel aktivitet, er ikke toksiske og kan derfor bruges inden for medicin og biologi..
-Dens nanopartikler kan danne det, der kaldes kvanteprikker. De absorberer og udsender stråling med større intensitet end mange fluorescerende organiske molekyler, så de kan erstatte sidstnævnte som biologiske markører.
-Strukturerne af α-AgtoS får det til at udvise slående elektroniske egenskaber, der skal bruges som solceller. Ligeledes repræsenterer det et udgangspunkt for syntesen af nye termoelektriske materialer og sensorer..
Referencer
- Mark Peplow. (17. april 2018). Halvledersølvsulfid strækker sig som metal. Hentet fra: cen.acs.org
- Samarbejde: Forfattere og redaktører af bind III / 17E-17F-41C () Sølvsulfid (Ag2S) krystalstruktur. I: Madelung O., Rössler U., Schulz M. (red.) Ikke-tetraedrisk bundne elementer og binære forbindelser I. Landolt-Börnstein - gruppe III kondenseret stof (numeriske data og funktionelle forhold i videnskab og teknologi), bind 41C. Springer, Berlin, Heidelberg.
- Wikipedia. (2018). Sølvsulfid. Hentet fra: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Juli 2016). AgtoS sølvsulfid nanopartikler og kolloide opløsninger: Syntese og egenskaber. Hentet fra: sciencedirect.com
- Azo Materials. (2018). Sølvsulfid (AgtoS) Halvledere. Hentet fra: azom.com
- A. Nwofe. (2015). Udsigter og udfordringer ved tynde film med sølvsulfid: En gennemgang. Afdeling for materialevidenskab og vedvarende energi, Institut for Industriel Fysik, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Forelæsningsdemonstrationer: rengøring af lakeret sølv. Hentet fra: lecturedemos.chem.umass.edu
- Undersøgelse. (2018). Hvad er sølvsulfid? - Kemisk formel og anvendelser. Hentet fra: study.com

Endnu ingen kommentarer