
Faust teknik fundament og materialer, trin, fordele, ulemper
Det Faust teknik Det er en metode, der tillader koncentration af nogle parasitæg og / eller larver indeholdt i fæces ved flotation. Det bruges, når direkte afføringstest er negative, eller når du ønsker at få rene prøver fri for detritus.
Koncentrationsmetoder til coproparasitologiske undersøgelser er af tre typer: ved flotation, ved sedimentering eller ved metoder, der kombinerer de to foregående. Disse metoder øger chancerne for positive resultater.

Faust-metoden består i at blande en del af afføringsprøven med et stof, der er tættere end de æg eller parasitter, der skal koncentreres. Dette medfører, at de er mindre tætte og flyder på overfladen. Supernatantvæsken opsamles og ses under et mikroskop til identifikation og kvantificering..
Denne metode bruges til at visualisere helminth æg. Til gengæld har det vist sig at være en meget følsom metode til diagnose af Giardia lamblia, en flagelleret protozo, bredt spredt over hele verden. Flotationsmetoder anbefales ikke til meget tunge parasitæg som bændelorm og trematoder..
Parasitter er en af de mest udbredte tarminfektioner på verdensplan, især i fattige lande med dårlige sanitære forhold. Af denne grund er det meget nyttigt at have følsomme metoder, der tillader identifikation og kvantificering af disse parasitter, til diagnose og behandling..
Artikelindeks
- 1 Fundament og materialer
- 1.1 Materialer
- 2 trin
- 2.1 Makroskopisk og mikroskopisk undersøgelse
- 2.2 Original Faust-teknik
- 2.3 Faustteknik ved centrifugering
- 3 fordele
- 4 Ulemper
- 5 Referencer
Fundament og materialer
Teknikken er baseret på eksistensen af de forskellige specifikke vægte af æg, parasitter, cyster, larver og detritus ved hjælp af zinksulfatopløsninger som en flotationsmetode..
Begrundelsen for teknikken er at blande prøven med en zinksulfatopløsning, der har en højere densitet end lettere æg, larver eller parasitter..
Dette gør det muligt for de tungeste elementer at udfældes, og de lettere kan flyde, der vises i supernatanten efter centrifugering af prøverne..
Materialer
- Forbered en zinksulfatopløsning med en densitet på 1,18 eller 1,2 g / ml, hvis prøven tidligere var behandlet.
- Forbered et stativ med tidligere mærkede reagensglas.
- Har en centrifugal maskine.
- Har objektglas og dækglas ved hånden. Alle skal mærkes
- Sørg for tilgængelighed af en Lugols løsning til pletter på arkene.
- Har gasbind til at filtrere.
- Har tragte og destilleret vand.
- Find mærkede plast- eller papbeholdere.
- Også applikatorer og sterilt håndtag på 5 mm.
- En lighter til at sterilisere håndtaget.
Trin
Makroskopisk og mikroskopisk undersøgelse
For enhver afføringundersøgelse begynder undersøgelsen med det, der kaldes "makroskopisk undersøgelse" af prøverne..
Konsistensen, farven, tilstedeværelsen af det, der ser ud til at være blod, tilstedeværelsen af slim og tilstedeværelsen af voksne parasitter er beskrevet..
Derefter går vi videre til "mikroskopisk undersøgelse" af afføringen, dette afhænger af metoden. Den enkleste er metoden med direkte udstrygning, som er den enkleste mikroskopiske observationsmetode for parasitter..
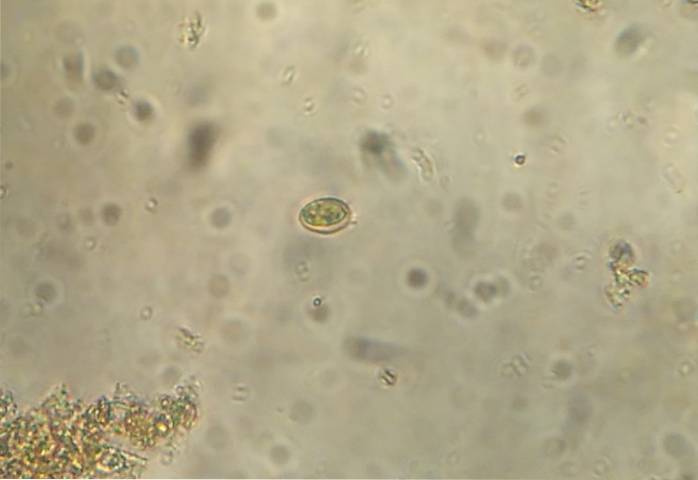
Fremgangsmåden involverer at placere en lille mængde af prøven direkte på et dias. Anbring flere dråber saltopløsning, der skal have samme størrelse som prøven. Bland saltopløsningen med afføringen, indtil der dannes en homogen blanding. Placer et dækglas og undersøge under mikroskopet.
Original Faust teknik
Den anden procedure består af Faust-flotationsmetoden, hvis oprindelige version består af:
1- Anbring ca. to gram afføring i en egnet beholder til dette formål.
2- Tilsæt 30 ml zinksulfatflotationsopløsning, hvormed der fremstilles en emulsion ved at blande opløsningen med afføringen.
3- Sil med en metalfilter i en anden beholder og overfør til et reagensglas.
4- Tilsæt mere flotationsopløsning, indtil der dannes en menisk i røret.
5- Anbring et glas dækglas på menisken. Lad det hvile i 10 til 15 minutter.
6- Fjern dækglas og placer det på et dias, der undersøges under mikroskopet.
Faust-teknik ved centrifugering
Oprindeligt anvendte metoden ikke centrifugering, men den er nu inkluderet, da der opnås bedre resultater. Teknikken involverer en række trin for at opnå en korrekt procedure, disse er som følger:
1- Afføringen vaskes med vand, blandes godt og filtreres derefter med gaze foldet i fire. Prøven anbringes i et reagensglas.
2- Centrifuger og fjern supernatanten (prøver, der holdes over vand). Trin 1 og 2 gentages, indtil supernatanten er "klar".
3- Zinksulfat tilsættes til den filtrerede og centrifugerede prøve.
4- Blandes godt.
5- Centrifuger igen i 1 minut ved 2500 omdr./min (omdrejninger pr. Minut).
6- Supernatanten udvindes med en steril sløjfe på ca. 5 mm; rørene skal ikke rystes.
7- Prøven udvundet fra supernatanten placeres på et dias, og en dråbe Lugol kan placeres i farve, dækglas placeres og observeres under mikroskopet.
8- Beholderne og reagensglas er mærket.
Fordel
- Elementerne, der bruges til diagnosen, kan observeres rene og uden “detritus”, dette letter observationen af arket og reducerer den tid, der bruges til diagnosen..
- I supernatanten udvindes både larver, æg og / eller cyster.
- Det er en meget billig metode.
- Proceduren er meget enkel og nem at implementere.
- Diagnosen er hurtig og præcis.
- På grund af vigtigheden og den høje forekomst af parasitose i fattige lande er disse billige og brugervenlige metoder ideelle til diagnose og overvågning af disse patologier..
Ulemper
Densiteten af flotationsopløsningen frembringer en sammentrækning af larverne, dvs. de krymper og kan i meget kort periode deformeres. Dette tvinger undersøgeren til straks at stille diagnosen, og de behandlede prøver kan ikke opbevares til fremtidige undersøgelser..
Som med alle mikroskopiske identifikationsmetoder kræves det en meget erfaren undersøgelsespersonale for at stille nøjagtige diagnoser..
Den hurtige deformation af de nødvendige elementer til diagnosen, selvom de er en åbenbar ulempe, kan korrigeres ved at foretage øjeblikkelige mikroskopiske observationer.
Referencer
- Ananias, F. L. (2017). Evaluering af Faust-metodens følsomhed og spontan sedimentering til diagnose af giardiasis. Cubansk Journal of Tropical Medicine, 68(to).
- Bartlett, M. S., Harper, K., Smith, N., Verbanac, P., & Smith, J. W. (1978). Sammenlignende evaluering af en modificeret zinksulfatflotationsteknik. Tidsskrift for klinisk mikrobiologi, 7(6), 524-528.
- Becker, A. C., Kraemer, A., Epe, C., & Strube, C. (2016). Følsomhed og effektivitet af udvalgte koproskopiske metoder-sedimentation, kombineret zinksulfatsedimentation-flotation og McMaster-metode. Parasitologi forskning, 115(7), 2581-2587.
- Garcia, L. S., Arrowood, M., Kokoskin, E., Paltridge, G. P., Pillai, D. R., Procop, G. W.,… & Visvesvara, G. (2018). Laboratoriediagnose af parasitter fra mave-tarmkanalen. Kliniske mikrobiologiske anmeldelser, 31(1), e00025-17.
- Summers, W. A. (1942). En modifikation af zinksulfatcentrifugalflotationsmetode til genvinding af helminth-æg i formaliniseret afføring. Journal of Parasitology, 28(4), 345-346.



Endnu ingen kommentarer