
Aromatiske nukleofile substitutionseffekter, eksempler
Det aromatisk nukleofil substitution (SNAr) er en reaktion, der forekommer i organisk kemi, som består i forskydning af en god forlader gruppe af en indkommende nukleofil. Set ud fra dets mekanisme og elektroniske aspekter er det den modsatte side af den elektrofile aromatiske substitution (SEAr).
Generelt er den fraspaltelige gruppe et halogen, der kommer ud som en halogenidanion X-. Denne reaktion kan kun finde sted, hvis den aromatiske ring (for det meste benzen) mangler elektroner; det vil sige, hvis den har elektronudtagende substituentgrupper.

Det øverste billede skitserer, hvad der blev sagt i det foregående afsnit. Elektronattraktorgruppen EWG (for dets akronym på engelsk: Elektronudtagningsgruppe), aktiverer den aromatiske ring til det nukleofile angreb af den negative art Nu-. Det kan ses, at der dannes et mellemprodukt (i midten), hvorfra halogenidet X frigives eller kommer ud-.
Bemærk, at X i enkle vendinger erstatning for Nu i en aromatisk ring. Denne reaktion er meget alsidig og nødvendig i syntesen af nye lægemidler såvel som i syntetiske organiske kemiundersøgelser..
Artikelindeks
- 1 Generelle aspekter
- 1.1 Forskelle med den elektrofile aromatiske substitution
- 2 effekter
- 2.1 Af antallet af substituenter
- 2.2 Fra den fratrædende gruppe
- 3 Eksempel
- 3.1 Afsluttende kommentar
- 4 Referencer
Generelle egenskaber
Den aromatiske ring kan "oplades" eller "aflades" af elektroner afhængigt af, hvad dens substituenter er (dem, der erstatter den oprindelige C-H-binding).
Når disse substituenter kan donere elektrondensitet til ringen, siges de at berige den med elektroner; Hvis de tværtimod er tiltrækkere af elektrondensitet (EWG nævnt ovenfor), siges det at de udarmede ringen af elektroner.
I begge tilfælde aktiveres ringen til en bestemt aromatisk reaktion, mens den deaktiveres for den anden..
F.eks. Siges en elektronrig aromatisk ring at være aktiv til elektrofil aromatisk substitution; det vil sige, det kan donere sine elektroner til en elektrofil art, E.+. Det donerer dog ikke elektroner til en Nu-art-, da negative afgifter ville afvise hinanden.
Hvis ringen nu er ringe med elektroner, har den ingen måde at give dem til arter E+ (SEAr forekommer ikke); på den anden side har den tilgængeligheden til at acceptere elektronerne af Nu-arten- (SNAr er udviklet).
Forskelle med aromatisk elektrofil substitution
Når de generelle inputaspekter er afklaret, kan nogle forskelle mellem SNAr og SEAr nu vises:
- Den aromatiske ring fungerer som en elektrofil (elektronmangel) og angribes af en nukleofil.
- En forlader gruppe X er substitueret på ringen; ikke en H+
- Karbokationer dannes ikke, men formidlere med en negativ ladning, der kan delokaliseres ved resonans
- Tilstedeværelsen af flere tiltrækningsgrupper i ringen fremskynder substitutionen i stedet for at bremse den
- Endelig har disse grupper ingen direkte virkninger på, hvor (på hvilket kulstof) substitutionen vil forekomme. Substitutionen vil altid ske på det carbon, der er bundet til den fraspaltelige gruppe X.
Det sidste punkt er også illustreret i billedet: C-X-bindingen brydes for at danne den nye C-Nu-binding.
Effekter rediger
Af antallet af substituenter
Jo mere elektronfattig ringen er, jo hurtigere er rSNA og jo mindre drastiske betingelser, der kræves for at den kan forekomme. Overvej følgende eksempel repræsenteret i billedet nedenfor:
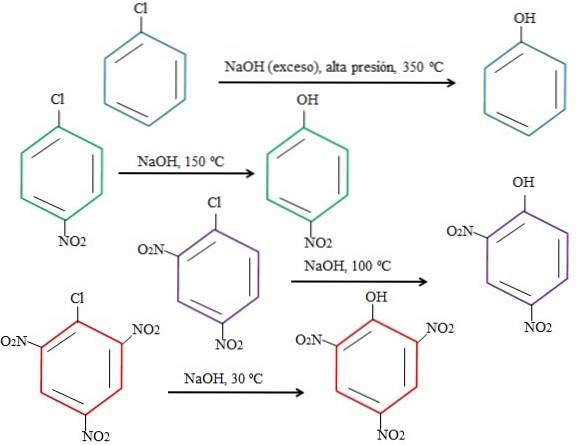
Bemærk, at 4-nitrochlorbenzen (blå ring) kræver drastiske betingelser (højt tryk og en temperatur på 350 ºC) for at substitutionen af Cl med OH kan forekomme. I dette tilfælde er klor den fraspaltelige gruppe (Cl-og hydroxid nukleofilen (OH-).
Når gruppen NO visesto, som er en elektrontiltrækker (grøn ring), kan substitutionen udføres ved en temperatur på 150 ° C ved omgivende tryk. Efterhånden som antallet af NO-grupper stigerto til stede (lilla og røde ringe) finder substitutionen sted ved lavere og lavere temperaturer (henholdsvis 100 ° C og 30 ° C).
Derfor er grupperne IKKEto fremskynde rSNA og fratage ringen af elektroner, hvilket gør den mere modtagelig for OH-angreb-.
De relative positioner af Cl med hensyn til NO vil ikke blive forklaret her.to i 4-nitrochlorbenzen, og hvordan disse ændrer reaktionshastigheden; For eksempel er reaktionshastighederne for 2-nitrochlorbenzen og 3-nitrochlorbenzen forskellige, idet sidstnævnte er den langsomste sammenlignet med de andre isomerer.
Fra den udgående gruppe
Genoptagelse af 4-nitrochlorbenzen er dens substitutionsreaktion langsommere sammenlignet med dens fluorerede modstykke:
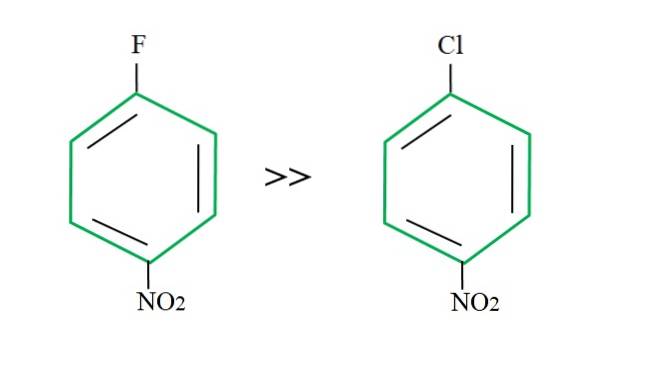
Forklaringen på dette kan ikke ligge i nogen anden variabel end forskellen mellem F og Cl. Fluor er en frygtelig forlader gruppe, da C-F-bindingen er sværere at bryde end C-Cl-bindingen. Derfor er afbrydelsen af denne binding ikke det afgørende trin for hastigheden for SNAr, men tilføjelsen af Nu- til den aromatiske ring.
Fordi fluor er mere elektronegativ end klor, har det carbonatom, der er knyttet til det, en større elektronisk mangel (Cδ+-Fδ-). Derfor er kulstoffet i CF-bindingen meget mere modtagelig for at blive angrebet af Nu- end C-Cl-bindingen. Derfor er substitutionen af F for OH meget hurtigere end for Cl for OH.
Eksempel
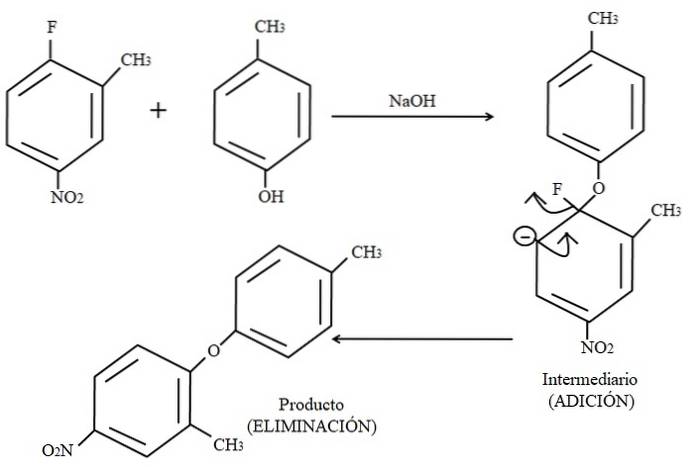
Endelig vises et eksempel på denne type organiske reaktioner nedenfor i billedet ovenfor. Para-cresol ser ikke ud til at være en nukleofil; men da der er et basisk medium, deprotoneres dets OH-gruppe, hvilket efterlader det som en phenoxidanion, der angriber 2-methyl-4-nitrofluorbenzen.
Når dette angreb opstår, siges nukleofilen at føje til elektrofilen (den aromatiske ring af 2-methyl-4-nitrofluorbenzen). Dette trin kan ses til højre for billedet, hvor den mellemliggende forbindelse dannes med begge substituenter, der hører til ringen.
Når para-cresol tilføjes, vises en negativ ladning, der delokaliseres ved resonans i ringen (bemærk, at den holder op med at være aromatisk).
Kun den sidste resonansstruktur er vist på billedet, hvorfra fluor ender som F-; men i virkeligheden bliver den negative ladning delokaliseret, selv i iltatomerne i NO-gruppento. Efter tilsætningstrinnet kommer elimineringstrinet, det sidste, det er når produktet endelig dannes.
Endelig kommentar
Gruppen NOto rest kan reduceres til NH-gruppento, og derfra er det muligt at udføre flere syntesereaktioner for at modificere det endelige molekyle. Dette fremhæver det syntetiske potentiale ved rSNA, og at dets mekanisme også består af to trin: et til addition og det andet til eliminering..
I øjeblikket er der imidlertid eksperimentelle og beregningsmæssige beviser for, at reaktionen faktisk fortsætter i henhold til en samordnet mekanisme, hvor begge trin forekommer samtidigt gennem et aktiveret kompleks og ikke et mellemprodukt..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Wikipedia. (2019). Nukleofil aromatisk erstatning. Gendannet fra: en.wikipedia.org
- James Ashenhurst. (06. september 2019). Nukleofil aromatisk substitution (NAS). Gendannet fra: masterorganicchemistry.com
- Kemi LibreTexts. (5. juni 2019). Nukleofil aromatisk erstatning. Gendannet fra: chem.libretexts.org


Endnu ingen kommentarer