
Kinyoun farvning begrundelse og teknikker

Det Kinyoun plet er en farvningsteknik, der bruges til at plette syrefaste bakterier og parasitter. Det blev født af ændringen af Ziehl-Neelsen-farven; Begge teknikker fortolkes på samme måde, men adskiller sig i to elementer: i fremstillingen af hovedreagenset og ved at Kinyoun-teknikken ikke bruger varme.
Af denne grund er det også kendt som koldmodificeret Ziehl-Neelsen eller Kinyoun koldt plet. Det er angivet til farvning af Mycobacterium tuberculosis, Mycobacterium leprae, atypiske mycobakterier, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris Y Cyclosporas cayetanensis.
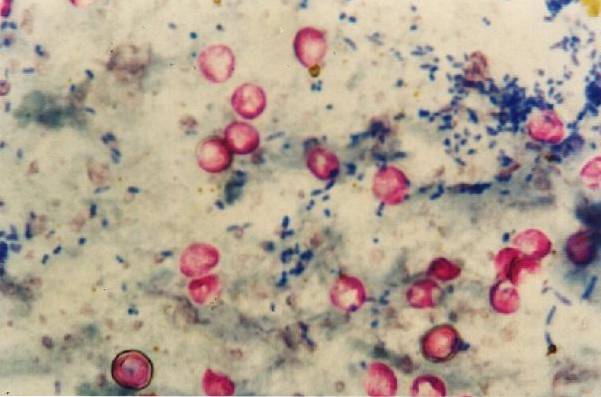
Det er værd at bemærke, at Nocardia pletter svagt med denne teknik, da de er delvist syre-alkoholresistente, så for denne slægt er der en ændring af metoden.
Til gengæld er den kolde Kinyoun-teknik blevet kombineret med trichrome-teknikken modificeret af Didier til påvisning af coccidia (Cryptosporidium parvum og Isospora belli) og microsporidia sporer (Enterocytozoon bieneusi Y Encephalitozoon intestinalis).
Artikelindeks
- 1 begrundelse
- 2 Teknik
- 2.1 Materialer
- 2.2 Forberedelse af Kinyouns carbol fuchsin
- 2.3 Fremstilling af syre-alkoholen
- 2.4 Fremstilling af methylenblåt kontrastfarvestof
- 2.5 Kinyoun farvningsteknik
- 2.6 Speciel Kinyoun-teknik til nokardier
- 2.7 Kombineret carbol fuchsin og trichrome teknik modificeret af Didier
- 2.8 Kvalitetskontrol
- 3 Kinyoun-teknik sammenlignet med Ziehl-Neelsen-teknikken
- 4 Reference
Basis
Hovedfarvningsreagenset er carbolfuchsin eller carbolfuchsin, som har den egenskab at binde til de carbolsyrer, der findes inden i den voksagtige cellevæg, der er rig på lipider (mycolsyrer) af mycobakterier og visse parasitter..
Denne binding modvirkes ikke af syreblegemidlet; derfor er mikroorganismer defineret som syre-alkoholresistente.
I modsætning til Ziehl-Neelsen-teknikken - som fikserer farvestoffet gennem varme - i Kinyoun-teknikken er dette trin ikke nødvendigt, da carbol-fuchsinopløsningen fremstillet til denne teknik indeholder en høj koncentration af phenol..
Phenol opløser lipidmaterialet i cellevæggen, så carbolfuchsin-farvestoffet kan komme ind. Når farvestoffet er trængt ind, forbliver det fast på trods af vask med den sure alkohol.
På denne måde får syreresistente mikroorganismer den karakteristiske røde farve, mens alt, hvad der ikke er syreresistent, bliver misfarvet og farvet blåt..
Teknik
Materialer
- Modificeret carbol fuchsin.
- Alkohol-syre.
- Methylenblåt.
Forberedelse af Kinyoun Carbol Fuchsin
- Grundlæggende fuchsin: 4 gr.
- Phenol: 8 ml.
- Alkohol (95%): 20 ml.
- Destilleret vand: 100 ml.
Den basale fuchsin skal opløses langsomt i alkoholen og blandes konstant. Derefter smeltes den krystalliserede phenol i et vandbad ved 56 ° C. Når det er opløst, tilsættes 8 ml til fuchsinopløsningen fremstillet ovenfor.
Fremstilling af syre-alkoholen
- Koncentreret saltsyre: 3 ml.
- Ethanol (95%): 97 ml.
Det skal måles, sammenføjes og blandes.
Fremstilling af det methylenblå kontrastfarvestof
- Methylenblåt: 0,3 g.
- Destilleret vand: 100 ml.
Den vejes og opløses.
Kinyoun farvningsteknik
1- Forbered et udstrygning direkte fra prøven, som blandt andet kan være sputum, lungevæske, urinsediment, cerebrospinalvæske eller afføring; eller fra en suspension af mikroorganismer opnået fra rene kolonier udviklet i primære dyrkningsmedier.
2- Fastgør udstrygningen med varme.
3- Anbring udstrygningen på farvningsbroen og dæk med det forberedte Kinyoun carbol fuchsin reagens. Lad det hvile i 3 eller 5 minutter.
4- Vask med destilleret vand.
5- Bleg med sur alkohol i 3 minutter og vask igen med destilleret vand.
6- Bleg igen med syrealkohol i 1 eller 2 minutter, indtil der ikke mere farves med farve.
7- Vask med destilleret vand og lad det dræne, og placer objektglasset i lodret position.
8- Dæk præparatet med methylenblåt, og lad det virke i 4 minutter.
9- Vask med destilleret vand og lad det lufttørre.
10- Undersøg ved 40X og derefter ved 100X.
Hvis du vil forbedre og fremskynde farvningen af syrehurtige mikroorganismer, skal du tilføje 1 dråbe fugtemiddel (såsom Tergitol nr. 7) til 30 eller 40 ml Kinyoun Carbol Fuchsin.
Nogle laboratorier ændrer det methylenblå kontrastfarvestof til lysegrøn eller pikrinsyre; den første giver baggrunden en grøn farve, og den anden genererer en gul farve.
Speciel Kinyoun-teknik til nokardier
For at forbedre farvningen af bakterier af slægten Nocardia anvendes en modifikation af Kinyoun-pletten. Teknikken er som følger:
1- Dæk udstrygningen med Kinyoun carbol fuchsin i 3 minutter.
2- Vask med destilleret vand.
3- Misfarv kort med sur alkohol fremstillet ved 3%, indtil der ikke bæres mere farve.
4- Vask igen med destilleret vand.
5- Dæk præparatet med methylenblåt og lad det stå i 30 sekunder.
6- Vask med destilleret vand og lad det lufttørre.
Kombineret carbol fuchsin og trichrome teknik modificeret af Didier
Denne teknik anbefales til analyse af afføringsprøver for coccidia og sporer af Microsporidium sp på samme tid. Proceduren, der skal følges, er som følger:
1- Dæk udstrygningen med Kinyoun carbol fuchsin i 10 minutter.
2- Fjern farvestoffet og vask med destilleret vand.
3- Bleg i 30 sekunder med saltsyrealkohol.
4- Vask igen med destilleret vand.
5- Dæk udstrygningen med trichromopløsning i 30 minutter ved 37 ° C.
6- Vask med destilleret vand.
7- Bleg i 10 sekunder med eddikesyrealkohol.
8- Vask udstrygningen i 30 sekunder med 95% ethanol.
QA
Som en positiv kontrol fremstilles udstrygninger med stammer af Mycobacterium tuberculosis og pletter med de tilberedte reagenser for at kontrollere, at bakterierne får den rigtige farve (rød-fuchsia).
Negative kontroller kan også bruges til at forberede udstrygninger med enhver stamme, der ikke er syrefast, og derved verificeres, at hele prøven får den kontrasterende farve..
Kinyoun-teknik sammenlignet med Ziehl-Neelsen-teknikken
Kinyoun-teknikken er enklere, da den eliminerer opvarmningstrinnet, men den største fordel er, at den på lang sigt undgår emission af dampe, meget giftige og kræftfremkaldende. Derfor er Kinyoun-pletten sikrere for farvningspersonale..
Det er vigtigt at tage højde for, at man skal være opmærksom på, at reagenserne ikke kommer i direkte kontakt med huden, da de er ætsende, og blegemidlet er brandfarligt..
Hvad angår ulemperne, indikerer en negativ udstrygning ikke nødvendigvis, at organismen ikke er til stede. Derudover kan tilstedeværelsen af cellulært affald føre til falske positive, hvilket fører til forvirring i diagnosen..
Reference
- Anvendt klinisk kemi. (2016). BK Kinyoun Kit.Tilgængelig på: cromakit.es
- Orozco-Rico Miguel. Kinyoun-plet og to Coccidia i HIV. Medical Journal MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Argentina. Redaktionel Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. udgave). Argentina, redaktionelt Panamericana S.A.
- Wikipedia-bidragydere. "Kinyoun-plet." Wikipedia, The Free Encyclopedia. Wikipedia, The Free Encyclopedia, 8. februar 2018. Web. 5. januar 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Implementering af en farvningsteknik til samtidig diagnose af Coccidia og Microsporidia. Institut for Hygiejne ved Republikken Universitet. Montevideo. Uruguay. Fås på: hygiene.edu.uy

Endnu ingen kommentarer