
Kaliumiodid (KI) struktur, egenskaber, opnåelse, anvendelser, risici

Det kaliumiodid er en uorganisk forbindelse dannet af en kaliumion (K+) og en iodidion (I-). Dens kemiske formel er KI. Det er et hvidt krystallinsk fast stof, ionisk og meget opløseligt i vand..
KI gør det muligt at udføre forskellige kemiske reaktioner og analyser og bruges til at måle mængden af ozon i atmosfæren. Anvendes også i infrarødt (IR) analyseudstyr.

Kaliumjodid tilsættes til almindeligt bordsalt for at forhindre jodmangel hos mennesker, da dette kan være et alvorligt helbredsproblem.
Det bruges som et slimløsende middel, da det hjælper slim med at strømme let fra åndedrætskanalerne udad. Det bruges også til behandling af nogle svampeinfektioner og bruges i nogle kosmetik.
Det bruges af dyrlæger til at helbrede dyr med lignende problemer som mennesker, såsom hoste og hudinfektioner. Det tilsættes endda i meget små mængder til dyrefoder.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3,7 pH
- 3.8 Kemiske egenskaber
- 3.9 Andre egenskaber
- 4 Opnåelse
- 5 anvendelser
- 5.1 Ved behandling af hyperthyreoidisme
- 5.2 I andre medicinske applikationer
- 5.3 I veterinære applikationer
- 5.4 Til beskyttelse af skjoldbruskkirtlen i radioaktive nødsituationer
- 5.5 I målinger af ozon i atmosfæren
- 5.6 I forskellige anvendelser
- 6 risici
- 7 Referencer
Struktur
Kaliumiodid er en ionforbindelse dannet af kaliumkationen K+ og iodidanionen I-, derfor er bindingen ionisk mellem de to. Oxidationstilstanden af kalium er +1, og iodens valens er -1.
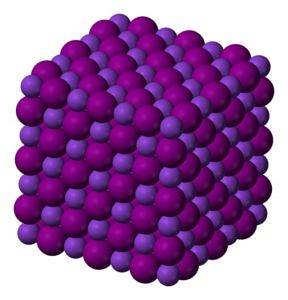
KI-kaliumiodidkrystaller er kubiske.
Nomenklatur
- Kaliumiodid
- Kaliumiodid
Ejendomme
Fysisk tilstand
Farveløst til hvidt krystallinsk fast stof. Kubiske krystaller.
Molekylær vægt
166,003 g / mol
Smeltepunkt
681 ºC
Kogepunkt
1323 ºC
Massefylde
3,13 g / cm3
Opløselighed
Meget opløselig i vand: 149 g / 100 g vand ved 25 ° C. Let opløselig i ethanol og ether.
pH
Dens vandige opløsninger er neutrale eller basiske med en pH mellem 7 og 9.
Kemiske egenskaber
Lidt hygroskopisk i fugtig luft.
Den er stabil i tør luft. Lys og fugt fremskynder nedbrydningen, og dens farve skifter til gul på grund af frigivelsen af små mængder jod (Ito) og iodater (IO3-).
Vandige KI-opløsninger bliver også gule over tid, men lidt alkali kan forhindre dette.
Disse opløsninger opløser iod (Ito) giver KI3:
jeg- + jegto → Jeg3-
Andre egenskaber
Det har en stærkt bitter og saltvandssmag. Det er ikke brandfarligt.
Opnåelse
Kaliumiodid kan opnås ved opvarmning af jod (Itoi en koncentreret opløsning af kaliumhydroxid (KOH):
3 Ito + 6 KOH → 5 KI + KIO3 + HtoELLER
Den resulterende iodat- og iodidopløsning opvarmes for at fjerne vand, reduceres til tørhed, trækul tilsættes og opvarmes til høj temperatur. Kul tager ilt fra iodat og oxiderer til kuldioxid, hvilket reducerer iodat til iodid:
2 KIO3 + C → 2 KI + 3 COto
Det opnåede kaliumiodid kan omkrystalliseres til oprensning. Det vil sige, det genopløses i vand og induceres til at krystallisere igen..
Ansøgninger
Til behandling af hyperthyreoidisme
Kaliumiodid fungerer som en yderligere behandling sammen med andre antithyroidmidler til behandling af hyperthyroidisme.
Hyperthyroidisme er en sygdom, der får skjoldbruskkirtlen til at producere for meget skjoldbruskkirtelhormon med en forstørret skjoldbruskkirtlen, et fald i vægt, et hurtigt hjerterytme og irritabilitet blandt andre symptomer..
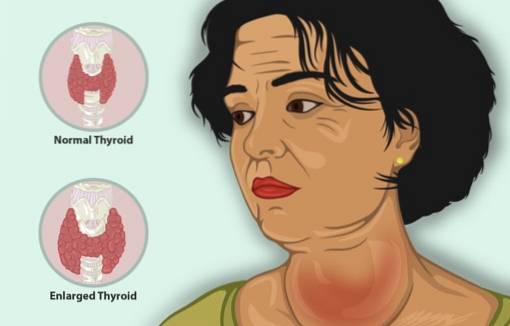
Hos patienter med hyperthyreoidisme reducerer KI hurtigt symptomer, da det hæmmer frigivelsen af skjoldbruskkirtelhormon.
Dens virkninger på skjoldbruskkirtlen er: fald i antallet af blodkar i kirtlen, opstrammende væv og reduktion af cellernes størrelse.
Af denne grund anvendes det som en præoperativ behandling for at inducere involvering eller formindskelse af skjoldbruskkirtlen før en thyroidektomi (fjernelse af skjoldbruskkirtlen), da dette letter denne operation..
I andre medicinske applikationer
Kaliumiodid har slimløsende egenskaber, da det øger udskillelsen af åndedrætsvæsker, hvilket resulterer i et fald i slimviskositet..

Det bruges til at behandle erythema nodosum, som er en smertefuld hævelse i benene, hvor der dannes røde knuder og en stigning i temperaturen.
Det er et svampedræbende middel. Det muliggør behandling af sporotrichosis, som er en hudinfektion forårsaget af en svamp. Denne sygdom sker for mennesker, der arbejder med planter og jord, såsom landmænd og gartnere..
Det bruges også til behandling af jodmangel eller for at undgå det, og det tilsættes derfor til bordsalt eller spiseligt salt (natriumchlorid NaCl) som en kilde til jod og undertiden i drikkevand.
I veterinære applikationer
Kaliumiodid administreres til dyr som et antitussivmiddel, for at øge og flydende væsker i luftvejene til kronisk bronchial hoste såvel som i tilfælde af gigt og som et antiinflammatorisk middel.
Det bruges også til mykose (svampeinfektioner) hos dyr for at reducere kløe og til kronisk forgiftning med bly eller kviksølv.
Ved beskyttelse af skjoldbruskkirtlen i radioaktive nødsituationer
Kaliumiodid har skjoldbruskkirtelbeskyttende egenskaber, hvis personen har været udsat for nuklear stråling.
KI oversvømmer skjoldbruskkirtlen med ikke-radioaktivt jod og blokerer dermed optagelsen af radioaktive molekyler og absorptionen af radioaktivt jod og beskytter skjoldbruskkirtlen mod kræft, som stråling kan forårsage..
I målinger af ozon i atmosfæren
Ozongas (O3) kan måles i atmosfæren ved hjælp af elektrolytiske celler kaldet ozonesondes, som bæres af radiosonde balloner.
Disse elektrolytiske celler indeholder en KI-kaliumiodidopløsning. Celler er oprindeligt i kemisk og elektrisk ligevægt.
Når en ozonluftprøve (O3) trænger ind i en af cellerne, brydes ligevægten, fordi følgende reaktion forekommer:
2 KI + O3 + HtoO → Ito + ELLERto + 2 KOH
Denne reaktion producerer en elektrisk strøm, der flyder mellem cellerne..
Mængden af produceret elektrisk strøm transmitteres kontinuerligt af radiobølger til en station på jorden. På denne måde opnås ozonprofilen fra jorden til kuglens højde..

I forskellige anvendelser
Kaliumiodid tillader også:
- Eliminering af frie radikaler, såsom hydroxylradikalen OH.
- Fremstilling af fotografiske emulsioner til udfældning af sølv.
- Forbedre dyrefoder ved at blive tilsat i mikromængder.
- Lugtfri husdyrgødning.
- Overfør lyset fra det infrarøde spektrum i IR-analyseudstyr.
- Udfør visse kemiske reaktioner og analyser i kemilaboratorier.
- Brug det i produkter til personlig hygiejne.
- Udfør miljøforureningsanalyse.
Risici
Nogle mennesker, der er følsomme over for iodider, bør tage det med forsigtighed, da det kan forårsage iodisme eller kronisk jodforgiftning, for eksempel dem med en autoimmun skjoldbruskkirtelsygdom..
Personer med tuberkulose eller akut bronkitis bør også være forsigtige.
KI kan forårsage blødgøring af spytkirtlerne, det kan brænde mund eller hals, usædvanlig stigning i spyt, tandsmerter og betændelse i tandkødet og metallisk smag, blandt andre symptomer..
Det kan også irritere øjnene og åbne sår på huden..
Referencer
- OS. National Library of Medicine. (2019). Kaliumiodid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde udgave. John Wiley & Sons.
- Dean, J.A. (redaktør). (1973). Lange's Chembook. Ellevte udgave. McGraw-Hill Book Company.
- Valkovic, V. (2019). Dekontaminering efter strålingseksponering. Mest følsomme kropsdele. In Radioactivity in the Environment (Anden udgave). Gendannet fra sciencedirect.com.
- Smit, H.G.J. (2015). Kemi af atmosfærens observationer for kemi (in situ). I Encyclopedia of Atmospheric Sciences (Anden udgave). Gendannet fra sciencedirect.com.
- Muralikrishna, I.V. og Manickam, V. (2017). Analytiske metoder til overvågning af miljøforurening. I miljøledelse. Gendannet fra sciencedirect.com.
- Wallace, J.M. og Hobbs, P.V. (2006). Atmospheric Chemistry 1. In Atmospheric Science (Anden udgave). Gendannet fra sciencedirect.com.



Endnu ingen kommentarer