
Voltammetri hvad det består af, typer og applikationer
Det voltammetri Det er en elektroanalytisk teknik, der bestemmer information om en kemisk art eller analyt ud fra de elektriske strømme, der genereres af variationen af et anvendt potentiale. Det vil sige, det anvendte potentiale E (V) og tiden (t) er de uafhængige variabler; mens strømmen (A), den afhængige variabel.
Den kemiske art skal normalt være elektroaktiv. Hvad betyder det? Det betyder, at det skal miste (oxidere) eller få (reducere) elektroner. For at reaktionen kan starte, skal arbejdselektroden levere det nødvendige potentiale teoretisk bestemt af Nernst-ligningen.
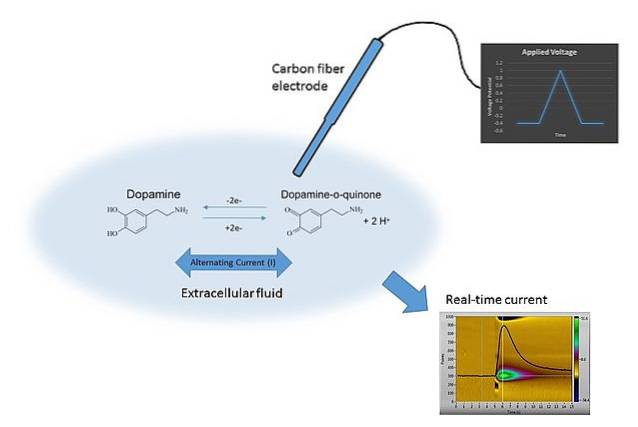
Et eksempel på voltammetri kan ses på billedet ovenfor. Elektroden i billedet er lavet af kulfibre, der nedsænkes i opløsningsmediet. Dopamin oxiderer ikke og danner to carbonylgrupper C = O (højre side af den kemiske ligning), medmindre det rette potentiale anvendes.
Dette opnås ved scanning E med forskellige værdier, begrænset af mange faktorer, såsom opløsningen, de tilstedeværende ioner, den samme elektrode og dopamin..
Ved at variere E over tid opnås to grafer: den første Evt (den blå trekant) og den anden svaret C vs t (gul). Dens former er karakteristiske til bestemmelse af dopamin under eksperimentets betingelser..
Artikelindeks
- 1 Hvad er voltammetri??
- 1.1 Voltammetrisk bølge
- 1.2 Instrumentering
- 2 slags
- 2.1 Puls voltammetri
- 2.2 Genopløsnings voltammetri
- 3 applikationer
- 4 Referencer
Hvad er voltammetri?
Voltammetri blev udviklet takket være opfindelsen af polarografiteknikken af Nobelprisvinderen i kemi i 1922, Jaroslav Heyrovsky. I den fornyes og polariseres elektroden til kviksølvdråben (EGM) konstant.
De analytiske mangler ved denne metode på det tidspunkt blev løst ved brug og design af andre mikroelektroder. Disse varierer enormt i materiale, fra kulstof, ædle metaller, diamanter og polymerer, til deres design, skiver, cylindre, ark; og også på den måde, hvorpå de interagerer med løsningen: stationær eller roterende.
Alle disse detaljer er beregnet til at favorisere polariseringen af elektroden, hvilket forårsager et henfald af den registrerede strøm kendt som grænsestrøm (i1). Dette er proportionalt med koncentrationen af analytten og halvdelen af styrken E (E.1/2) for at nå halvdelen af den aktuelle strøm (i1/2) er karakteristisk for arten.
Derefter bestemmelse af værdierne for E.1/2 på kurven, hvor den opnåede strøm med variationen af E kaldes voltamperogram, tilstedeværelsen af en analyt kan identificeres. Det vil sige, at hver analyt, givet betingelserne for eksperimentet, vil have sin egen værdi af E.1/2.
Voltammetrisk bølge
I voltammetri arbejder du med mange grafer. Den første af dem er E vs t-kurven, som gør det muligt at følge op på de anvendte potentielle forskelle som en funktion af tiden.
Men på samme tid registrerer det elektriske kredsløb C-værdierne produceret af analytten ved at miste eller vinde elektroner i nærheden af elektroden..
Fordi elektroden er polariseret, kan mindre analyt diffundere inden i opløsningen ind i den. For eksempel, hvis elektroden er positivt ladet, arten X- vil blive tiltrukket af det og vil gå mod det ved blot elektrostatisk tiltrækning.
Men X- Du er ikke alene: der er andre ioner til stede i dit miljø. Nogle kationer M+ de kan komme i vejen for elektroden ved at omslutte den i "klynger" af positive ladninger; og ligeledes N anioner- kan blive fanget rundt om elektroden og forhindre X- Jeg kom til ham.
Summen af disse fysiske fænomener får strøm til at gå tabt, og dette observeres i C vs E-kurven og dens form svarende til en S, kaldet sigmoidform. Denne kurve er kendt som en voltametrisk bølge..
Instrumentering
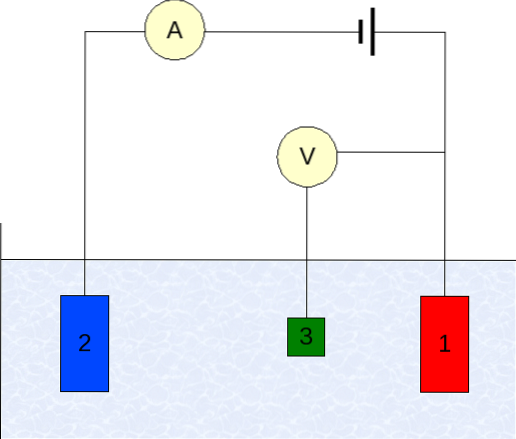
Instrumenteringen til voltammetri varierer alt efter analyt, opløsningsmiddel, type elektrode og anvendelse. Men langt størstedelen af dem er baseret på et system, der består af tre elektroder: en til arbejde (1), hjælpestøtte (2) og referencen (3)..
Den primære anvendte referenceelektrode er calomel-elektroden (ECS). Dette sammen med arbejdselektroden gør det muligt at etablere en potentiel forskel AE, da potentialet for referenceelektroden forbliver konstant under målingerne..
På den anden side er hjælpelektroden ansvarlig for at styre den ladning, der passerer til arbejdselektroden, for at holde den inden for acceptable E-værdier. Den uafhængige variabel, den anvendte potentialeforskel, er den, der opnås ved at tilføje potentialerne for arbejds- og referenceelektroderne..
Typer

Ovenstående billede viser en E vs t-graf, også kaldet en potentiel bølge for en lineær fejevoltammetri..
Det kan ses, at efterhånden som tiden går, øges potentialet. Til gengæld genererer denne fejning en responskurve eller voltamperogram C vs E, hvis form vil være sigmoid. Der kommer et punkt, hvor uanset hvor meget E stiger, vil der ikke være nogen stigning i strømmen.
Andre typer voltammetri kan udledes af denne graf. Hvordan? Ændring af potentialbølgen E vs t gennem pludselige potentialepulser efter bestemte mønstre. Hvert mønster er forbundet med en type voltammetri og omfatter sin egen teori og eksperimentelle forhold..
Puls voltammetri
I denne type voltammetri kan blandinger af to eller flere analytter, hvis E-værdier analyseres1/2 er meget tæt på hinanden. Således er en analyt med E1/2 på 0,04 V kan identificeres i selskab med en anden med en E.1/2 på 0,05 V. Mens det er i lineær fejevoltammetri, skal forskellen være større end 0,2 V..
Derfor er der højere følsomhed og lavere detektionsgrænser; dvs. analytter kan bestemmes ved meget lave koncentrationer.
Potentialebølger kan have mønstre, der ligner trapper, skrå trapper og trekanter. Sidstnævnte svarer til cyklisk voltammetri (CV for dets akronym på engelsk, første billede).
I CV anvendes et potentiale E i en retning, positivt eller negativt, og derefter, ved en bestemt værdi af E på tidspunktet t, anvendes det samme potentiale igen, men i den modsatte retning. Når man studerer de genererede voltampogrammer, afslører maksimumene tilstedeværelsen af mellemled i en kemisk reaktion.
Genopløsnings voltammetri
Dette kan være af anodisk eller katodisk type. Den består af elektrodepositionen af analytten på en kviksølvelektrode. Hvis analytten er en metalion (såsom Cdto+), dannes en amalgam; og hvis det er en anion (som MoO4to-) et uopløseligt kviksølvsalt.
Derefter påføres impulser af potentialer for at bestemme koncentrationen og identiteten af den elektrodeponerede art. Således opløses amalgamen igen, ligesom kviksølvsalte.
Ansøgninger
-Anodisk genopløsnings voltammetri bruges til at bestemme koncentrationen af opløste metaller i væske.
-Det gør det muligt at studere kinetikken ved redox eller adsorptionsprocesser, især når elektroderne er modificeret til at detektere en bestemt analyt.
-Dets teoretiske grundlag er blevet brugt til fremstilling af biosensorer. Med disse kan tilstedeværelsen og koncentrationen af biologiske molekyler, proteiner, fedtstoffer, sukker osv. Bestemmes..
-Endelig opdager den deltagelse af formidlere i reaktionsmekanismerne.
Referencer
- González M. (22. november 2010). Voltammetri. Gendannet fra: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Elektrokemisk analyse. Journal of Biological Diagnosis, 51 (1), 18-27. Gendannet fra scielo.isciii.es
- Kemi og videnskab. (18. juli 2011). Voltammetri. Gendannet fra: laquimicaylaciencia.blogspot.com
- Quiroga A. (16. februar 2017). Cyklisk voltammetri. Gendannet fra: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Voltammetriske teknikker. [PDF]. Tufts University. Gendannet fra: brown.edu
- Dag R. & Underwood A.. Kvantitativ analytisk kemi (femte udgave). PEARSON Prentice Hall.


Endnu ingen kommentarer