
Jodhistorie, egenskaber, struktur, opnåelse, risici, anvendelser
Det jod Det er et reaktivt ikke-metallisk element, der hører til gruppe 17 i det periodiske system (halogener) og er repræsenteret af det kemiske symbol I. I det væsentlige er det et ret populært element, fra iodiseret vand til hormonet tyrosin.
I fast tilstand er jod mørkegråt med en metallisk glans (nederste billede), der er i stand til at sublimere til dannelse af en violet damp, der efter kondensering på en kold overflade efterlader en mørk rest. Talrige og attraktive har været eksperimenterne for at demonstrere disse egenskaber.

Dette element blev isoleret for første gang af Bernard Curtois i år 1811, mens man opnåede forbindelser, der tjente som råmateriale til fremstilling af saltpeter. Imidlertid identificerede Curtois ikke jod som et element, en fortjeneste delt af Joseph Gay-Lussac og Humphry Davy. Gay-Lussac identificerede elementet som "iode", et udtryk, der stammer fra det græske ord "ioides", som farven violet blev betegnet med..
Elementært iod er ligesom de andre halogener et diatomisk molekyle, der består af to iodatomer bundet af en kovalent binding. Van der Waals-interaktionen mellem jodmolekyler er den stærkeste blandt halogener. Dette forklarer, hvorfor jod er halogenet med de højeste smelte- og kogepunkter. Derudover er det den mindst reaktive af halogenerne og den med den laveste elektronegativitet..
Jod er et væsentligt element, der skal indtages, da det er nødvendigt for kropsvækst; hjerne og mental udvikling metabolisme generelt osv., der anbefaler en daglig indtagelse på 110 µg / dag.
Jodmangel i en persons fostertilstand er forbundet med udseendet af kretinisme, en tilstand der er kendetegnet ved en langsommere kropsvækst; såvel som utilstrækkelig mental og intellektuel udvikling, strabismus osv..
I mellemtiden er en jodmangel i enhver alder hos individet forbundet med udseendet af en struma, der er kendetegnet ved en hypertrofi af skjoldbruskkirtlen. Goiter er en endemisk sygdom, da den er begrænset til visse geografiske områder med deres egne ernæringsmæssige egenskaber.
Artikelindeks
- 1 Historie
- 1.1 Opdagelse
- 1.2 Fremkomst af navnet
- 1.3 Historiske anvendelser
- 2 Fysiske og kemiske egenskaber
- 2.1 Udseende
- 2.2 Standard atomvægt
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 Opløselighed
- 2.8 Lugt
- 2.9 Octanol / vand fordelingskoefficient
- 2.10 Nedbrydning
- 2.11 Viskositet
- 2.12 tredobbelt punkt
- 2.13 Kritisk punkt
- 2.14 Fusionsvarme
- 2.15 Fordampningsvarme
- 2.16 Molær varmekapacitet
- 2.17 Damptryk
- 2.18 oxidationstal
- 2.19 Elektronegativitet
- 2.20 Ioniseringsenergi
- 2.21 Varmeledningsevne
- 2.22 Elektrisk modstand
- 2.23 Magnetisk rækkefølge
- 2.24 Reaktivitet
- 3 Struktur og elektronisk konfiguration
- 3.1 - Jodatom og dets bindinger
- 3.2 - Krystaller
- 3.3 - Faser
- 4 Hvor kan man finde og hente
- 4.1 Caliche
- 4.2 Saltvand
- 5 Biologisk rolle
- 5.1 - Anbefalet diæt
- 5.2 - Skjoldbruskkirtelhormoner
- 5.3 - Mangel
- 6 risici
- 7 anvendelser
- 7.1 Læger
- 7.2 Reaktioner og katalytisk virkning
- 7.3 Fotografi og optik
- 7.4 Andre anvendelser
- 8 Referencer
Historie
Opdagelse
Jod blev opdaget af den franske kemiker Bernard Curtois i år 1811, mens han arbejdede med sin far i produktionen af saltpeter, hvilket krævede natriumcarbonat til dette..
Denne forbindelse blev isoleret fra tang, som de samlede ud for kysterne i Normandiet og Bretagne. Til dette formål blev algerne brændt, og asken blev vasket med vand og ødelagde de resulterende rester med tilsætning af svovlsyre..
Ved en lejlighed, måske ved en tilfældig fejltagelse, tilføjede Curtois et overskud af svovlsyre, og der dannedes en lilla damp, der krystalliserede på de kolde overflader og bundfældede sig som mørke krystaller. Curtois mistænkte, at han var i nærværelse af et nyt element og kaldte det "Substance X".
Curtois opdagede, at dette stof, når det blev blandet med ammoniak, dannede et brunt fast stof (nitrogentriiodid), der eksploderede ved den mindste kontakt.
Imidlertid havde Curtois begrænsninger for at fortsætte sin forskning og besluttede at give prøver af sit stof til Charles Desormes, Nicolas Clément, Joseph Gay-Lussac og André-Marie Ampère for at opnå deres samarbejde..
Navnets fremkomst
I november 1813 offentliggjorde Desormes og Clément Curtois opdagelse. I december samme år påpegede Gay-Lussac, at det nye stof kunne være et nyt element, hvilket antydede navnet "iode" fra det græske ord "ioides", der er udpeget til violet..
Sir Humphry Davy, der modtog en del af prøven, der blev givet til Ampère af Curtois, eksperimenterede med prøven og bemærkede en lighed med klor. I december 1813 var Royal Society of London involveret i identifikationen af et nyt element.
Selvom der opstod en diskussion mellem Gay-Lussac og Davy om identifikation af jod, erkendte de begge, at Curtois var den første til at isolere det. I 1839 modtog Curtois endelig Montyn-prisen fra Royal Academy of Sciences i anerkendelse af isoleringen af jod..
Historiske anvendelser
I 1839 gav Louis Daguerre jod sin første kommercielle anvendelse ved at opfinde en metode til fremstilling af fotografiske billeder kaldet daguerreotypier på tynde metalplader..
I 1905 undersøgte den amerikanske patolog David Marine jodmangel i visse sygdomme og anbefalede dets indtagelse.
Fysiske og kemiske egenskaber
Udseende

Massiv mørkegrå med metallisk glans. Når sublimeret, er dampene lilla i farve (øverste billede).
Standard atomvægt
126,904 u
Atomnummer (Z)
53
Smeltepunkt
113,7 ºC
Kogepunkt
184,3 ºC
Massefylde
Omgivelsestemperatur: 4,933 g / cm3
Opløselighed
Det opløses i vand til dannelse af brune opløsninger med en koncentration på 0,03% ved 20 ºC..
Denne opløselighed forøges betydeligt, hvis der tidligere er opløst iodidioner, da der er etableret en ligevægt mellem I- og jegto at danne den anioniske art I3-, der opløses bedre end jod.
I organiske opløsningsmidler såsom chloroform, carbontetrachlorid og carbondisulfid opløses iod, hvilket giver en lilla farvetone. Ligeledes opløses det i nitrogenholdige forbindelser, såsom pyridin, quinolin og ammoniak, for igen at danne en brun opløsning.
Forskellen i farvningerne ligger i, at jodet opløses som solvatiserede molekyler Ito, eller som lastoverførselskomplekser; sidstnævnte vises, når de er polære opløsningsmidler (vand blandt dem), der opfører sig som Lewis-baser ved at donere elektroner til jod.
Lugt
Skarp, irriterende og karakteristisk. Lugttærskel: 90 mg / m3 og irriterende lugtgrænse: 20 mg / m3.
Fordelingskoefficient for oktanol / vand
Log P = 2,49
Nedbrydning
Når det opvarmes til nedbrydning, udsender det en røg af hydrogeniodid og forskellige iodidforbindelser..
Viskositet
2.27 cP ved 116 ºC
Triple point
386,65 K og 121 kPa
Kritisk punkt
819 K og 11,7 MPa
Fusionsvarme
15,52 kJ / mol
Fordampningsvarme
41,57 kJ / mol
Molær varmekapacitet
54,44 J / (mol K)
Damptryk
Jod har et moderat damptryk, og når beholderen åbnes, sublimerer den langsomt til en violet damp, der irriterer øjnene, næsen og halsen..
Oxidationsnumre
Oxidationsnumrene for jod er: -1 (I-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) og +7 (I7+). I alle iodidsalte, som i tilfældet med KI, har jod et oxidationsnummer på -1, da vi i dem har anionen I-.
Jod erhverver positive oxidationstal, når det kombineres med elementer, der er mere elektronegative end det; for eksempel i dets oxider (ItoELLER5 og jeg4ELLER9) eller interhalogenerede forbindelser (I-F, I-Cl og I-Br).
Elektronegativitet
2.66 på Pauling-skalaen
Ioniseringsenergi
Først: 1.008,4 kJ / mol
Andet: 1.845 kJ / mol
Tredje: 3.180 KJ / mol
Varmeledningsevne
0,449 W / (m K)
Elektrisk modstand
1,39 107 Ω · m ved 0 ºC
Magnetisk rækkefølge
Diamagnetisk
Reaktivitet
Jod kombineres med de fleste metaller til dannelse af iodider og også med ikke-metalliske grundstoffer som fosfor og andre halogener. Jodidionen er et stærkt reduktionsmiddel, som spontant frigiver en elektron. Oxidation af iodid producerer en brunlig farvetone.
Jod er i modsætning til iodid et svagt oxidationsmiddel; svagere end brom, klor og fluor.
Jod med oxidationsnummer +1 kan kombineres med andre halogener med oxidationsnummer -1 for at give jodhalogenider; for eksempel: iodbromid, IBr. Ligeledes kombineres det med brint for at give anledning til brintiodid, der efter opløsning i vand kaldes hydrojodsyre..
Hydroiodic syre er en meget stærk syre, der er i stand til at danne iodider ved reaktion med metaller eller deres oxider, hydroxider og carbonater. Jod har en +5 oxidationstilstand i jodsyre (HIO3), som er dehydreret til dannelse af iodpentoxid (ItoELLER5).
Struktur og elektronisk konfiguration
- Jodatom og dets bindinger

Jod i sin jordtilstand består af et atom, der har syv valenselektroner, kun en fra at være i stand til at færdiggøre sin oktet og blive isoelektronisk med ædelgas-xenon. Disse syv elektroner er arrangeret i deres 5s og 5p orbitaler i henhold til deres elektroniske konfiguration:
[Kr] 4d10 5sto 5 s5
Derfor viser jeg-atomer en stærk tendens til at binde kovalent, så hver enkelt har otte elektroner i sin yderste skal. Således nærmer sig to I-atomer og danner I-I-bindingen, som definerer det diatomiske molekyle Ito (øverste billede); molekylær enhed af jod i sine tre fysiske tilstande under normale forhold.
Billedet viser molekyle Ito repræsenteret af en rumlig påfyldningsmodel. Det er ikke kun et diatomisk molekyle, men også homonukleært og apolært; så deres intermolekylære interaktioner (Ito - jegto) styres af Londons spredningsstyrker, som er direkte proportionale med deres molekylære masse og atomernes størrelse.
Denne I-I-binding er imidlertid svagere sammenlignet med den for de andre halogener (F-F, Cl-Cl og Br-Br). Dette skyldes teoretisk den dårlige overlapning af deres sp hybrid orbitaler3.
- Krystaller
Molekylmassen af Ito gør det muligt for dets spredningskræfter at være retningsbestemte og stærke nok til at etablere en orthorhombisk krystal ved omgivende tryk. Dens høje elektronindhold får lyset til at fremme endeløse energiovergange, hvilket får jodkrystallerne til at plette sort.
Men når jod sublimerer, viser dets dampe en violet farve. Dette er allerede tegn på en mere specifik overgang inden for molekylære orbitaler i Ito (dem med den højeste energi eller anti-link).
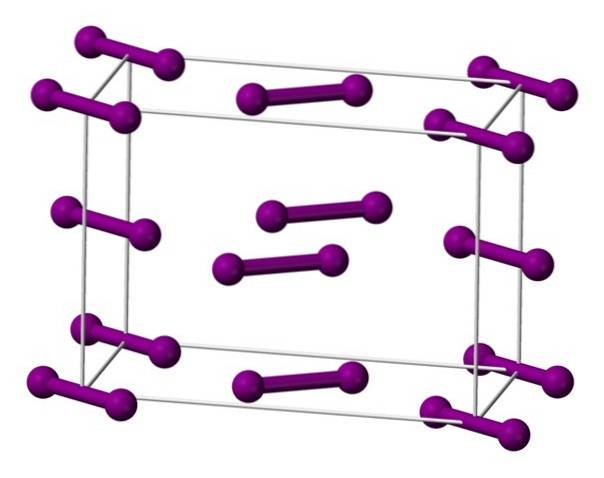
Molekyler I er vist ovenforto, repræsenteret af en model af kugler og søjler, arrangeret i den orthorhombiske enhedscelle.
Det kan ses, at der er to lag: det nederste med fem molekyler og det midterste med fire. Bemærk også, at et iodmolekyle sidder ved cellebunden. Glas er bygget ved periodisk at fordele disse lag i alle tre dimensioner..
Når man rejser retningen parallelt med I-I-bindingerne, viser det sig, at jodorbitalerne overlapper hinanden for at danne et ledningsbånd, hvilket gør dette element til en halvleder; dog forsvinder dets evne til at lede elektricitet, hvis retningen vinkelret på lagene følges.
Link afstande
I-I-linket ser ud til at være udvidet; og faktisk er det, da længden af dens binding stiger fra 266 pm (gasformet tilstand), til 272 pm (solid state).
Dette kan skyldes, at molekylerne I i gasto de er meget langt fra hinanden, deres intermolekylære kræfter er næsten ubetydelige; mens det er i det faste stof, bliver disse kræfter (I-I-I-I) håndgribelige, der tiltrækker jodatomer fra to nabomolekyler mod hinanden og dermed forkorter den intermolekylære afstand (eller interatomisk set på en anden måde).
Derefter, når jodkrystallen sublimerer, trækker I-I-bindingen sig sammen i gasfasen, da nabomolekyler ikke længere udøver den samme (dispersive) tiltrækkende kraft på deres omgivelser. Og også logisk set afstanden Ito - jegto øges.
- Faser
Det blev tidligere nævnt, at I-I-obligationen er svagere sammenlignet med de andre halogener. I gasfasen ved en temperatur på 575 ºC er 1% af molekylerne Ito de bryder op i individuelle I-atomer. Der er så meget varmeenergi, at bare to jeg er kommet sammen igen, de adskiller sig og så videre.
Tilsvarende kan denne bindingsbrydning forekomme, hvis der påføres et enormt tryk på jodkrystallerne. Ved at komprimere det for meget (under tryk hundreder af tusinder af gange højere end atmosfærisk), molekylerne Ito omarrangeres som en monatomisk fase I, og iod siges derefter at udvise metalliske egenskaber.
Der er imidlertid andre krystallinske faser, såsom: kropscentreret orthorhombisk (fase II), kropscentreret tetragonal (fase III) og ansigtscentreret kubisk (fase IV).
Hvor kan man finde og få
Jod har et vægtforhold i forhold til jordskorpen på 0,46 ppm og rangerer 61. i overflod i det. Iodidmineraler er knappe, og kommercielt udnyttelige jodaflejringer er iodater..
Jodmineraler findes i vulkanske klipper med en koncentration på 0,02 mg / kg til 1,2 mg / kg og i magmatiske klipper med en koncentration på 0,02 mg til 1,9 mg / kg. Det kan også findes i Kimmeridge-skifer med en koncentration på 17 mg / kg vægt.
Desuden findes iodmineraler i fosfatsten med en koncentration på fra 0,8 til 130 mg / kg. Havvand har en jodkoncentration, der varierer fra 0,1 til 18 µg / L. Tang, svampe og østers var tidligere de vigtigste kilder til jod.
I øjeblikket er de vigtigste kilder imidlertid caliche, natriumnitrataflejringer i Atacama-ørkenen (Chile) og saltlage, hovedsageligt fra det japanske gasfelt i Minami Kanto, øst for Tokyo, og Anadarko-gasfeltet. Basin i Oklahoma (USA).
Caliche
Jod ekstraheres fra caliche i form af iodat og behandles med natriumbisulfit for at reducere det til iodid. Opløsningen omsættes derefter med frisk ekstraheret iodat for at lette dets filtrering. Caliche var den vigtigste kilde til jod i det 19. og tidlige 20. århundrede..
Saltlagen
Efter oprensning behandles saltopløsningen med svovlsyre, som producerer iodid..
Denne iodidopløsning omsættes efterfølgende med klor til dannelse af en fortyndet iodopløsning, som fordampes af en luftstrøm, der omdirigeres til et absorberende tårn af svovldioxid, hvilket frembringer følgende reaktion:
jegto + 2 timertoO + SOto => 2 HI + HtoSW4
Derefter reagerer hydrogeniodidgassen med chlor for at frigive jodet i gasform:
2 HI + Clto => Jegto + 2 HCI
Og endelig filtreres, renses og pakkes jodet til brug..
Biologisk rolle
- Anbefalet diæt
Jod er et væsentligt element, da det griber ind i mange funktioner i levende væsener, som er især kendt hos mennesker. Den eneste måde, hvorpå jod kan komme ind i mennesket, er gennem den mad, han spiser.
Den anbefalede diæt til jod varierer med alderen. Et 6 måneder gammelt barn kræver således et indtag på 110 µg / dag; men fra en alder af 14 år er den anbefalede diæt 150 µg / dag. Derudover anføres det, at jodindtagelse ikke bør overstige 1.100 µg / dag.
- Skjoldbruskkirtelhormoner
Skjoldbruskkirtelstimulerende hormon (TSH) udskilles af hypofysen og stimulerer optagelsen af jod af skjoldbruskkirtlen. Jod transporteres ind i skjoldbruskkirtlen, kendt som kolloider, hvor det binder til aminosyren tyrosin til dannelse af monoiodotyrosin og diiodotyrosin..
I follikulært kolloid kombineres et molekyle af monoiodothyronin med et diiodothyroninmolekyle til dannelse af et molekyle kaldet triiodothyronin (T3). På den anden side kan to molekyler diiodotyrosin forbinde sig og danne tetraiodothyronin (T4). T3 og T4 kaldes skjoldbruskkirtelhormoner.
T-hormoner3 og T4 de udskilles i plasma, hvor de binder til plasmaproteiner; inklusive skjoldbruskkirtelhormontransportørprotein (TBG). De fleste af skjoldbruskkirtelhormoner transporteres i plasma som T4.
Imidlertid er den aktive form for skjoldbruskkirtelhormoner T3, så T4 i de "hvide organer" i skjoldbruskkirtelhormonerne gennemgår det deiodination og omdannes til T3 at udøve sin hormonelle virkning.
Effekter rediger
Virkningerne af virkningen af skjoldbruskkirtelhormoner er flere, hvor følgende er muligt at påpege: øget stofskifte og proteinsyntese; fremme af kropsvækst og hjerneudvikling forhøjet blodtryk og puls osv..
- Mangel
Manglen på jod og derfor skjoldbruskkirtelhormoner, kendt som hypothyroidisme, har adskillige konsekvenser, der er påvirket af personens alder.
Hvis jodmangel opstår under en persons føtal tilstand, er den mest relevante konsekvens kretinisme. Denne tilstand er kendetegnet ved tegn som nedsat mental funktion, forsinket fysisk udvikling, strabismus og forsinket seksuel modning..
En jodmangel kan inducere en struma, uanset i hvilken alder manglen opstår. En struma er en overudvikling af skjoldbruskkirtlen forårsaget af overdreven stimulering af kirtlen af hormonet TSH, frigivet fra hypofysen som et resultat af jodmangel..
Skjoldbruskkirtelens overdrevne størrelse (struma) kan komprimere luftrøret og begrænse luftens passage gennem den. Derudover kan det forårsage skade på strubehovednervene, der kan føre til hæshed..
Risici
Forgiftning ved overdreven indtagelse af jod kan forårsage forbrændinger i munden, halsen og feber. Også mavesmerter, kvalme, opkastning, diarré, svag puls og koma.
Et overskud af jod producerer nogle af de symptomer, der observeres ved en mangel: der er en hæmning af syntesen af skjoldbruskkirtelhormoner, hvilket øger frigivelsen af TSH, hvilket resulterer i en hypertrofi af skjoldbruskkirtlen; dvs. en struma.
Der er undersøgelser, der indikerer, at overdreven indtagelse af jod kan forårsage thyroiditis og papillær thyreoideacancer. Derudover kan et overdreven indtag af jod interagere med medicin, hvilket begrænser deres handling..
Overdreven indtagelse af jod sammen med antithyroid medicin, såsom methimazol, der anvendes til behandling af hyperthyroidisme, kan have en additiv virkning og forårsage hypothyroidisme..
Angiotensin-converting enzym (ACE) -hæmmere, såsom benazepril, anvendes til behandling af hypertension. At tage for meget kaliumiodid øger risikoen for hyperkalæmi og hypertension.
Ansøgninger
Læger
Jod fungerer som et desinfektionsmiddel for huden eller såret. Det har næsten øjeblikkelig antimikrobiel virkning, trænger ind i det indre af mikroorganismer og interagerer med svovlaminosyrer, nukleotider og fedtsyrer, hvilket forårsager celledød.
Det udøver sin antivirale virkning hovedsageligt på de dækkede vira og postulerer, at det angriber proteinerne på overfladen af de dækkede vira..
Kaliumiodid i form af en koncentreret opløsning anvendes til behandling af thyrotoksikose. Det bruges også til at kontrollere virkningerne af stråling fra 131I ved at blokere den radioaktive isotops binding til skjoldbruskkirtlen.
Jod bruges til behandling af dendritisk keratitis. For at gøre dette udsættes hornhinden for vanddampe mættet med jod og mister midlertidigt hornhindens epitel; men der er fuld restitution fra det på to eller tre dage.
Også jod har gavnlige virkninger ved behandlingen af cystisk fibrose i det menneskelige bryst. Ligeledes er det blevet påpeget, at 131Jeg kunne være en valgfri behandling med skjoldbruskkirtlen.
Reaktioner og katalytisk virkning
Jod bruges til at detektere tilstedeværelsen af stivelse, hvilket giver en blå nuance. Reaktionen af jod med stivelse bruges også til at detektere tilstedeværelsen af falske sedler, der er trykt på papir, der indeholder stivelse..
Kalium (II) tetraiodomercurat, også kendt som Nesslers reagens, anvendes til påvisning af ammoniak. Ligeledes anvendes en alkalisk iodopløsning i jodformtesten for at vise tilstedeværelsen af methylketoner..
Uorganiske iodider anvendes til oprensning af metaller, såsom titanium, zirconium, hafnium og thorium. I et trin i processen skal tetraiodiderne af disse metaller dannes.
Jod fungerer som en stabilisator for kolofonium, olie og andre træprodukter.
Jod bruges som katalysator i de organiske syntesereaktioner af methylering, isomerisering og dehydrogenering. I mellemtiden anvendes hydroiodsyre som en katalysator til produktion af eddikesyre i Monsanto- og Cativa-processerne..
Jod fungerer som en katalysator i kondensering og alkylering af aromatiske aminer såvel som ved sulfaterings- og sulfaneringsprocesser og til fremstilling af syntetiske gummier.
Fotografi og optik
Sølviodid er en vigtig komponent i traditionel fotografisk film. Jod anvendes til fremstilling af elektroniske instrumenter såsom prismer med enkelt krystal, polariserende optiske instrumenter og glas, der er i stand til at transmittere infrarøde stråler..
Andre anvendelser
Jod anvendes til fremstilling af pesticider, anilinfarvestoffer og phthalein. Derudover bruges det til syntese af farvestoffer og er et røgslukningsmiddel. Og til sidst tjener sølviodidet som en kondenseringskerne for vanddampen i skyerne for at forårsage regn..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Stuart Ira Fox. (2003). Human fysiologi. Første udgave. Redigere. McGraw-Hill Interamericana
- Wikipedia. (2019). Jod. Gendannet fra: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi & Onoda Mitsuko. (2003). Moduleret struktur af fast iod under dens molekylære dissociation under højt tryk. Naturvolumen 423, sider 971-974. doi.org/10.1038/nature01724
- Chen L. et al. (1994). Strukturelle faseovergange af jod ved højt tryk. Institut for Fysik, Academia Sinica, Beijing. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider & Karl Christe. (26. august 2019). Jod. Encyclopædia Britannica. Gendannet fra: britannica.com
- Dr. Doug Stewart. (2019). Fakta om jodelementer. Chemicool. Gendannet fra: chemicool.com
- National Center for Biotechnology Information. (2019). Jod. PubChem-database. CID = 807. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkører af ernæring til gennemgang af udviklingsjod. Journal of nutrition, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Jod. Kemi forklaret. Gendannet fra: chemistryexplained.com
- Traci Pedersen. (19. april 2017). Fakta om jod. Gendannet fra: livescience.com
- Megan Ware, RDN, LD. (30. maj 2017). Alt hvad du behøver at vide om jod. Gendannet fra: medicalnewstoday.com
- National Institute of Health. (9. juli 2019). Jod. Gendannet fra: ods.od.nih.gov


Endnu ingen kommentarer